【中国发明,中国发明授权】一种缺血修饰白蛋白检测试剂盒
有权-审定授权 中国
- 申请号:
- CN201310537257.6
- 专利权人:
- 山东博科生物产业有限公司
- 授权公告日/公开日:
- 2016.02.03
- 专利有效期:
- 2013.11.04-2033.11.04
- 技术分类:
- G01:测量;测试
- 转化方式:
- 转让
- 价值度指数:
-
- 61.0分
- 价格:
- ¥8000.00
- 专利信息&法律状态
- 专利自评
- 专利技术文档
- 价值度指数
- 发明人阵容
 著录项
著录项
- 申请号
- CN201310537257.6
- 申请日
- 20131104
- 公开/公告号
- CN103760357A
- 公开/公告日
- 20140430
- 申请/专利权人
- [山东博科生物产业有限公司]
- 发明/设计人
- [谭柏清, 王进, 甘宜梧]
- 主分类号
- G01N33/68
- IPC分类号
- C12N 9/0008(2013.01) C12N 9/16
- CPC分类号
- C12N 9/0008(2013.01) C12N 9/16(2013.01)
- 分案申请地址
- 国省代码
- 中国,CN,山东(37)
- 颁证日
- G06T1/00
- 代理人
- [李桂存]
 摘要
摘要
本发明涉及缺血修饰白蛋白含量检测技术领域,特别涉及一种缺血修饰白蛋白检测试剂盒,包括试剂1和试剂2,试剂1中含有缓冲液,氯化钴,稳定剂,防腐剂;试剂2中含有缓冲液,二硫苏糖醇,稳定剂,还原保护剂,防腐剂。可以加速钴离子与正常白蛋白结合的效率,在一定时间内,完全与正常白蛋白结合,保证了试剂检测样本结果的准确性;保护了二硫苏糖醇在溶液中的稳定性,而且不影响二硫苏糖醇与钴离子的结合,从而保证试剂室温开瓶避光保存稳定30天,2-8℃闭瓶保存稳定12个月,完全满足临床检验的需要;促进了二硫苏糖醇与钴离子的结合的结合速度,使试剂尽快达到反应重点,保证了试剂的高效检测效果,显著提高了试剂检测的准确度。
 法律状态
法律状态
| 法律状态公告日 | 20160203 |
| 法律状态 | 授权 |
| 法律状态信息 | 授权 |
| 法律状态公告日 | 20140604 |
| 法律状态 | 实质审查的生效 |
| 法律状态信息 | 实质审查的生效 IPC(主分类):G01N 33/68 申请日:20131104 |
| 法律状态公告日 | 20140430 |
| 法律状态 | 公开 |
| 法律状态信息 | 公开 |
 权利要求
权利要求
权利要求数量(9)
独立权利要求数量(1)
1.一种缺血修饰白蛋白检测试剂盒,其特征在于包括试剂1和试剂2,
其中,试剂1中含有以下组分:pH为7.5-8.5的缓冲液0.05~0.5mol/L,氯化钴10~40mmol/L,稳定剂0.1~5g/L,防腐剂 0.1~1g/L;
试剂2 中含有以下组分:pH为7.0-8.0的缓冲液0. 5~5mol/L,二硫苏糖醇20~40mmol/L,稳定剂 0.1~5g/L,还原保护剂1~10 mmol/L,防腐剂0.1~1g/L。
2.根据权利要求1所述的缺血修饰白蛋白检测试剂盒,其特征在于所述试剂1中的稳定剂为三乙醇胺。
3.根据权利要求1所述的缺血修饰白蛋白检测试剂盒,其特征在于所述试剂2中的稳定剂为烷基酚聚氧乙烯醚、高碳脂肪醇聚氧乙烯醚、三乙醇胺、烷基糖苷、曲拉通或吐温。
4.根据权利要求1所述的缺血修饰白蛋白检测试剂盒,其特征在于所述试剂2中的还原保护剂为谷胱甘肽、亚硫酸氢钠或巯基乙醇。
5.根据权利要求1所述的缺血修饰白蛋白检测试剂盒,其特征在于所述试剂1中的缓冲液为三羟甲基氨基甲烷缓冲液、3- 三羟甲基甲胺 -2- 羟基丙磺酸缓冲液或4- 羟乙基哌嗪丙磺酸缓冲液。
6.根据权利要求1所述的缺血修饰白蛋白检测试剂盒,其特征在于所述试剂1和试剂2中的防腐剂为叠氮化钠或PC300。
7.根据权利要求1所述的缺血修饰白蛋白检测试剂盒,其特征在于所述试剂2中的缓冲液为甘氨酸缓冲液、咪唑缓冲液或醋酸盐缓冲液。
8.根据权利要求1所述的缺血修饰白蛋白检测试剂盒,其特征在于所述试剂1与试剂2的体积比为 1~4:1。
9.根据权利要求1所述的缺血修饰白蛋白检测试剂盒,其特征在于所述试剂1与试剂2的体积比为 2:1。
1.一种缺血修饰白蛋白检测试剂盒,其特征在于包括试剂1和试剂2,
其中,试剂1中含有以下组分:pH为7.5-8.5的缓冲液0.05~0.5mol/L,氯化钴10~40mmol/L,稳定剂0.1~5g/L,防腐剂 0.1~1g/L;
试剂2 中含有以下组分:pH为7.0-8.0的缓冲液0. 5~5mol/L,二硫苏糖醇20~40mmol/L,稳定剂 0.1~5g/L,还原保护剂1~10 mmol/L,防腐剂0.1~1g/L。
2.根据权利要求1所述的缺血修饰白蛋白检测试剂盒,其特征在于所述试剂1中的稳定剂为三乙醇胺。
3.根据权利要求1所述的缺血修饰白蛋白检测试剂盒,其特征在于所述试剂2中的稳定剂为烷基酚聚氧乙烯醚、高碳脂肪醇聚氧乙烯醚、三乙醇胺、烷基糖苷、曲拉通或吐温。
4.根据权利要求1所述的缺血修饰白蛋白检测试剂盒,其特征在于所述试剂2中的还原保护剂为谷胱甘肽、亚硫酸氢钠或巯基乙醇。
5.根据权利要求1所述的缺血修饰白蛋白检测试剂盒,其特征在于所述试剂1中的缓冲液为三羟甲基氨基甲烷缓冲液、3- 三羟甲基甲胺 -2- 羟基丙磺酸缓冲液或4- 羟乙基哌嗪丙磺酸缓冲液。
6.根据权利要求1所述的缺血修饰白蛋白检测试剂盒,其特征在于所述试剂1和试剂2中的防腐剂为叠氮化钠或PC300。
7.根据权利要求1所述的缺血修饰白蛋白检测试剂盒,其特征在于所述试剂2中的缓冲液为甘氨酸缓冲液、咪唑缓冲液或醋酸盐缓冲液。
8.根据权利要求1所述的缺血修饰白蛋白检测试剂盒,其特征在于所述试剂1与试剂2的体积比为 1~4:1。
9.根据权利要求1所述的缺血修饰白蛋白检测试剂盒,其特征在于所述试剂1与试剂2的体积比为 2:1。
 说明书
说明书
下面结合实施例对本发明作进一步的详细说明,下述实施例只是用于解释本发明,而不是对本发明的技术方案的限制。
实施例1:
试剂1各组分及浓度为:
Tris缓冲液 (pH 7.6) 0.1mol/L,
氯化钴 20mmol/L,
PC-300 1g/L,
试剂2各组分及浓度为:
咪唑缓冲液(pH 7.0) 1mol/L,
二硫苏糖醇 20mmol/L,
PC-300 1g/L。
实施例1中的配方为FDA认可的市场上常规应用的一种配方,用作理论对照。
试剂 1 和试剂 2 的配制方法为常规方法,即试剂 1 和试剂 2 所述组分分别加入蒸馏水后各自混合搅匀即可。
本发明试剂盒测定样本中的 IMA 的测试条件如下 :
温度:37 ℃;比色杯光径为1.0 cm。检测波长 510 nm。(现在临床全自动生化分析仪器都能够达到该要求)
应用本发明IMA测定试剂盒测定样本中IMA的方法如下 :
样品(检测的样品包括蒸馏水、标准品和临床样本)加试剂1混匀,37℃孵育5 min后读取吸光度A0,立即加入试剂2混匀,37℃反应 5 min 后,读取吸光度 A1,ΔA = A1-A0。其中样本用量30μl,试剂1用量 200μl,试剂2用量 100μl。
本发明试剂盒测定样本中 IMA 含量按以下公式进行计算 :
单位定义 :每 ml 血清中白蛋白失去结合 1μg 钴离子的能力为 1 U。
实施例2:
试剂1各组分及浓度为:
Tris缓冲液 (pH 7.6) 0.1mol/L
氯化钴 20mmol/L
PC-300 1g/L
试剂2各组分及浓度为:
咪唑缓冲液(pH 7.0) 1mol/L
二硫苏糖醇 20mmol/L
巯基乙醇 6mol/L
PC-300 1g/L
实施例 2 试剂盒的制备方法同实施例 1,检测方法同实施例1。
实施例3
试剂1各组分及浓度为:
Tris缓冲液 (pH 7.6) 0.1mol/L
氯化钴 20mmol/L
PC-300 1g/L
试剂2各组分及浓度为:
咪唑缓冲液(pH 7.0) 1mol/L
二硫苏糖醇 20mmol/L
亚硫酸氢钠 6mol/L
PC-300 1g/L
实施例 3 试剂盒的制备方法同实施例 1,检测方法同实施例1。
实施例4:
试剂1各组分及浓度为:
Tris缓冲液 (pH 7.6) 0.1mol/L
氯化钴 20mmol/L
三乙醇胺 0.5g/L
PC-300 1g/L
试剂2各组分及浓度为:
咪唑缓冲液(pH 7.0) 1mol/L
二硫苏糖醇 20mmol/L
巯基乙醇 6mol/L
三乙醇胺 0.5g/L
PC-300 1g/L
实施例 4 试剂盒的制备方法同实施例 1,检测方法同实施例1。
实施例5:
试剂1各组分及浓度为:
Tris缓冲液 (pH 7.6) 0.05mol/L
氯化钴 10mmol/L
三乙醇胺 0.1g/L
PC-300 0.1g/L
试剂2各组分及浓度为:
咪唑缓冲液(pH 7.0) 0.5mol/L
二硫苏糖醇 20mmol/L
巯基乙醇 1mol/L
十六烷基糖苷 0.1g/L
PC-300 0.1g/L
实施例 5 试剂盒的制备方法同实施例 1,检测方法同实施例1。
实施例6:
Tris缓冲液 (pH 7.6) 0.5mol/L
氯化钴 40mmol/L
三乙醇胺 5g/L
PC-300 1g/L
试剂2各组分及浓度为:
咪唑缓冲液(pH 7.0) 5mol/L
二硫苏糖醇 40mmol/L
巯基乙醇 10mol/L
TX-100 5g/L
PC-300 1g/L
实施例6 试剂盒的制备方法同实施例 1,检测方法同实施例1。
实施例7:
试剂1各组分及浓度为:
Tris缓冲液 (pH 7.6) 0.1mol/L
氯化钴 20mmol/L
三乙醇胺 0.5g/L
PC-300 1g/L
试剂2各组分及浓度为:
咪唑缓冲液(pH 7.0) 1mol/L
二硫苏糖醇 20mmol/L
巯基乙醇 6mol/L
烷基酚聚氧乙烯醚 0.5g/L
PC-300 1g/L
实施例 7 试剂盒的制备方法同实施例 1,检测方法同实施例1。
实施例8:
试剂1各组分及浓度为:
Tris缓冲液 (pH 7.6) 0.1mol/L
氯化钴 20mmol/L
三乙醇胺 0.5g/L
PC-300 1g/L
试剂2各组分及浓度为:
咪唑缓冲液(pH 7.0) 1mol/L
二硫苏糖醇 20mmol/L
巯基乙醇 6mol/L
吐温-20 0.5g/L
PC-300 1g/L
实施例 8 试剂盒的制备方法同实施例 1,检测方法同实施例1。
试剂盒效率验证
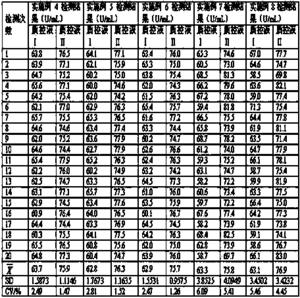
对理论靶值为20.4U/mL的样本1 、44.1U/mL的样本2、76.4 U/mL的样本3、114.6 U/mL的样本4、143.9U/mL的样本5在相同的检测条件下,采用实施例1、2、3、4制备的试剂盒对各个浓度进行检测,结果如表1所示:
表1 不同实施例检测反应达到终点的时间
由以上数据明显显示,本发明实施例4 配制的试剂达到终点的时间明显加快,说明试剂盒中加入去干扰剂和稳定剂显著加快了反应达到终点的试剂,试剂盒反应效率明显提高。
准确性、精密度实验
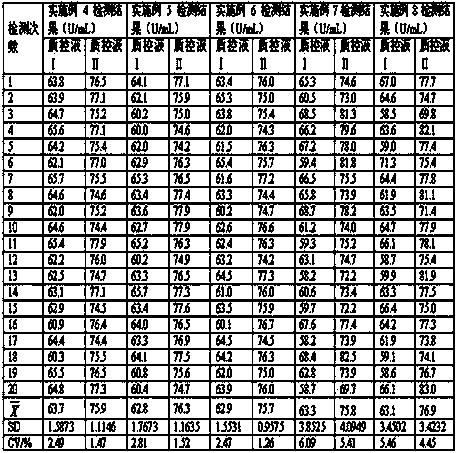
对靶值为 63.1±5 U/mL 的质控液Ⅰ和靶值为 76.4±5 U/mL 的质控液Ⅱ在相同条件下,采用实施例4、5、6、7、8制备的试剂盒对同一质控液的同一浓度连续检测20次,将检测结果的平均值与靶值范围进行比较,以检测所述的试剂盒的准确性,同时比较每个测定的变异系数,以检测所述的试剂盒实施例的准确性和精密度,结果如表2 所示:
表2试剂盒准确度、精密度检测结果
经过对中低值质控品检测,采用实施例4、5、6、7、8制备的试剂盒准确度在靶值要求的范围内,达到准确度要求,其中采用实施例4、5、6制备的试剂盒重复20次检测的变异系数都小于3,达到常规生化试剂CV(变异系数)≤5%的要求,而采用实施例7、8制备的试剂盒重复20次检测的变异系数出现大于5%的情况,本发明选用三乙醇胺、十六烷基糖苷或TX-100作为试剂2的稳定剂,更好地改善了试剂的准确度和精密度。
试剂盒稳定性实验
(1)37℃加速稳定性实验
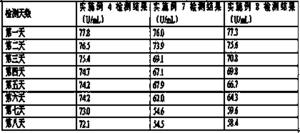
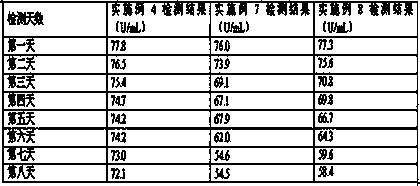
将实施例4、7、8配制的试剂进行 37℃加速稳定性实验(37℃加速稳定性试验保证了试剂在运输和短期存放期间的稳定性),需要达到7天后检测结果依然在靶值范围内。操作流程为:采用实施例4、7、8制备的试剂盒,分别按照试剂装量要求进行分装,三种试剂盒各需要8组试剂,每组试剂包含一瓶试剂1和一瓶试剂2,将24组试剂瓶放置在37℃水浴锅内,每种试剂盒每天定时取出一组对靶值为76.4±5 U/mL质控品进行检测,检测结果如表3所示 :
表3 37℃加速稳定性实验检测结果
通过以上数据,采用实施例4配制的试剂盒,虽然检测结果出现下降,但是结果偏差不大,经过37℃热加速7天后,检测结果还是在靶值范围内,采用实施例7、8配制的试剂盒随着时间增长,在37℃加速试验中检测结果下降严重,3天后已经严重偏出质控范围,对比检测结果,本发明实施例4配制的试剂37℃加速稳定性好。
(2)4-8 ℃稳定性实验
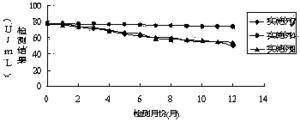
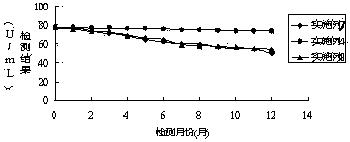
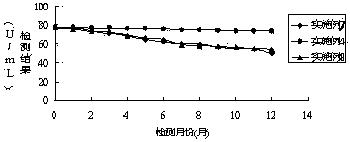
将实施例4、7、8配制的试剂进行4-8℃稳定性实验,检测试剂能否稳定保存 1 年,即在一年时间内检测结果都在靶值范围内。操作流程为:采用实施例4、7、8制备的试剂盒,分别按照试剂装量要求进行分装,两种试剂盒各需要13组试剂,每组试剂包含一瓶试剂1和一瓶试剂2,将39组试剂瓶放置在4-8℃冰箱内,每种试剂盒每天定时取出一组对靶值为76.4±5 U/mL质控品进行检测,检测结果如图1所示:
通过图1检测结果的变化趋势,采用实施例4配制的试剂随着放置时间的增长,试剂检测结果出现下滑,但是到一年(12个月)后,检测结果依旧在靶值范围内。然而采用实施例7、8配制的试剂,检测结果持续下降,在4个月后已经查处靶值的范围。通过对比检测结果,本发明采用实施例4配制的试剂盒能在4-8 ℃稳定保存12个月。
由稳定性检测数据显示,本发明采用实施例4配制的试剂稳定性好,能在37℃环境下稳定放置7天,同时在4-8℃闭瓶保存稳定12 个月,完全满足临床检验的需要。
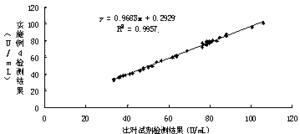
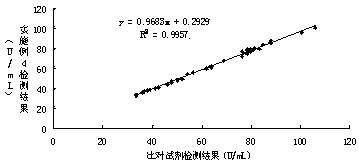
试剂盒比对相关性试验
采用实施例4配制的试剂,与市场上常见公认的某缺血修饰白蛋白检测试剂盒(比色法)进行对照检测,同时检测了40个临床血清样本,检测结果如图2所示,并获得了两种试剂的相关性曲线。通过图2检测结果显示,两个试剂盒的相关系数为0.9978,说明了两者有极大的相关性,从而证明了本发明的试剂盒与市场上应用的试剂盒临床检测结果具有一致性。
 价值度评估
价值度评估
技术价值
经济价值
法律价值
0 0 061.0分
0 50 75 100专利价值度是通过科学的评估模
型对专利价值进行量化的结果,
基于专利大数据针对专利总体特
征指标利用计算机自动化技术对
待评估专利进行高效、智能化的
分析,从技术、经济和法律价值
三个层面构建专利价值评估体
系,可以有效提升专利价值评估
的质量和效率。
总评:61.0分
该专利价值中等 (仅供参考)
本专利文献中包含【2 个技术分类】,从一定程度上而言上述指标的数值越大可以反映出所述专利的技术保护及应用范围越广。 【专利权的维持时间12 年】专利权的维持时间越长,其价值对于权利人而言越高。
技术价值 31.0
该指标主要从专利申请的著录信息、法律事件等内容中挖掘其技术价值,专利类型、独立权利要求数量、无效请求次数等内容均可反映出专利的技术性价值。 技术创新是专利申请的核心,若您需要进行技术借鉴或寻找可合作的项目,推荐您重点关注该指标。
部分指标包括:
授权周期(发明)
26 个月独立权利要求数量
0 个从属权利要求数量
0 个说明书页数
8 页实施例个数
0 个发明人数量
3 个被引用次数
0 次引用文献数量
0 个优先权个数
0 个技术分类数量
2 个无效请求次数
0 个分案子案个数
0 个同族专利数
0 个专利获奖情况
无保密专利的解密
否经济价值 8.0
该指标主要指示了专利技术在商品化、产业化及市场化过程中可能带来的预期利益。 专利技术只有转化成生产力才能体现其经济价值,专利技术的许可、转让、质押次数等指标均是其经济价值的表征。 因此,若您希望找到行业内的运用广泛的热点专利技术及侵权诉讼中的涉案专利,推荐您重点关注该指标。
部分指标包括:
申请人数量
1申请人类型
企业许可备案
0 次权利质押
0 次权利转移
0 个海关备案
否法律价值 22.0
该指标主要从专利权的稳定性角度评议其价值。专利权是一种垄断权,但其在法律保护的期间和范围内才有效。 专利权的存续时间、当前的法律状态可反映出其法律价值。故而,若您准备找寻权属稳定且专利权人非常重视的专利技术,推荐您关注该指标。
部分指标包括:
存活期/维持时间
12法律状态
有权-审定授权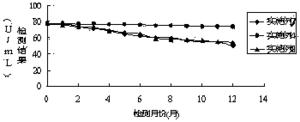
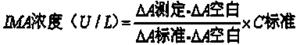
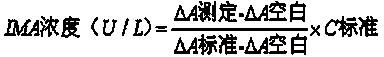








 苏公网安备 32041202001399号
苏公网安备 32041202001399号



 loading...
loading...