【中国发明,中国发明授权】一种酶标抗体试剂
有权-审定授权 中国
- 申请号:
- CN201310670322.2
- 专利权人:
- 山东博科生物产业有限公司
- 授权公告日/公开日:
- 2015.04.15
- 专利有效期:
- 2013.12.11-2033.12.11
- 技术分类:
- G01:测量;测试
- 转化方式:
- 转让
- 价值度指数:
-
- 61.0分
- 价格:
- ¥8000.00
- 专利信息&法律状态
- 专利自评
- 专利技术文档
- 价值度指数
- 发明人阵容
 著录项
著录项
- 申请号
- CN201310670322.2
- 申请日
- 20131211
- 公开/公告号
- CN103616506A
- 公开/公告日
- 20140305
- 申请/专利权人
- [山东博科生物产业有限公司]
- 发明/设计人
- [谭柏清, 王进, 甘宜梧]
- 主分类号
- G01N33/543
- IPC分类号
- C12N 9/0008(2013.01) C12N 9/16
- CPC分类号
- C12N 9/0008(2013.01) C12N 9/16(2013.01)
- 分案申请地址
- 国省代码
- 山东(37)
- 颁证日
- G06T1/00
- 代理人
- [李桂存]
 摘要
摘要
本发明涉及临床体外检测试剂技术领域,特别涉及一种酶标抗体试剂,包括组分1、组分2和组分3,组分1中含有pH为6.0的醋酸盐缓冲液,过碘酸钠,过氧化脲,三乙醇胺;组分2中含有无水碳酸钠,碳酸氢钠;组分3中含有硼氢化钠,甘氨酸,甘油。本发明提供的酶标记抗体试剂,直接对游离的抗体和HRP进行淬灭,不需要对酶结合物进行透析和纯化,直接可以应用到试剂盒中,不影响本底和检测结果;将常规标记流程中的过夜(18小时)降低到了2小时完成,大大节省了反应时间;将试剂放置到2~8℃和37℃环境中,试剂能稳定长期保存,稳定性良好,可以长久应用。
 法律状态
法律状态
| 法律状态公告日 | 20240123 |
| 法律状态 | 专利权质押登记、变更及注销 |
| 法律状态信息 | 专利权质押登记注销 IPC(主分类):G01N 33/543 授权公告日:20150415 申请日:20131211 专利号:ZL2013106703222 登记号:Y2023980042636 出质人:山东博科生物产业有限公司 质权人:济南农村商业银行股份有限公司天桥支行 注销日:20240105 |
| 法律状态公告日 | 20230620 |
| 法律状态 | 专利权质押合同登记的生效、变更及注销 |
| 法律状态信息 | 专利权质押合同登记的生效 IPC(主分类):G01N 33/543 专利号:ZL2013106703222 登记号:Y2023980042636 登记生效日:20230601 出质人:山东博科生物产业有限公司 质权人:济南农村商业银行股份有限公司天桥支行 发明名称:一种酶标抗体试剂 申请日:20131211 授权公告日:20150415 |
| 法律状态公告日 | 20230616 |
| 法律状态 | 专利权质押合同登记的生效、变更及注销 |
| 法律状态信息 | 专利权质押合同登记的注销 IPC(主分类):G01N 33/543 授权公告日:20150415 申请日:20131211 专利号:ZL2013106703222 登记号:Y2023980032056 出质人:山东博科生物产业有限公司 质权人:济南农村商业银行股份有限公司天桥支行 解除日:20230531 |
| 法律状态公告日 | 20230224 |
| 法律状态 | 专利权质押合同登记的生效、变更及注销 |
| 法律状态信息 | 专利权质押合同登记的生效 IPC(主分类):G01N 33/543 专利号:ZL2013106703222 登记号:Y2023980032056 登记生效日:20230206 出质人:山东博科生物产业有限公司 质权人:济南农村商业银行股份有限公司天桥支行 发明名称:一种酶标抗体试剂 申请日:20131211 授权公告日:20150415 |
| 法律状态公告日 | 20220712 |
| 法律状态 | 专利权质押合同登记的生效、变更及注销 |
| 法律状态信息 | 专利权质押合同登记的注销 IPC(主分类):G01N 33/543 授权公告日:20150415 申请日:20131211 专利号:ZL2013106703222 登记号:Y2021370000122 出质人:山东博科生物产业有限公司 质权人:济南农村商业银行股份有限公司天桥支行 解除日:20220624 |
| 法律状态公告日 | 20211119 |
| 法律状态 | 专利权质押合同登记的生效、变更及注销 |
| 法律状态信息 | 专利权质押合同登记的生效 IPC(主分类):G01N 33/543 专利号:ZL2013106703222 登记号:Y2021370000122 登记生效日:20211101 出质人:山东博科生物产业有限公司 质权人:济南农村商业银行股份有限公司天桥支行 发明名称:一种酶标抗体试剂 申请日:20131211 授权公告日:20150415 |
| 法律状态公告日 | 20150415 |
| 法律状态 | 授权 |
| 法律状态信息 | 授权 |
| 法律状态公告日 | 20140402 |
| 法律状态 | 实质审查的生效 |
| 法律状态信息 | 实质审查的生效IPC(主分类):G01N 33/543申请日:20131211 |
| 法律状态公告日 | 20140402 |
| 法律状态 | 实质审查的生效 |
| 法律状态信息 | 实质审查的生效 IPC(主分类):G01N 33/543 申请日:20131211 |
| 法律状态公告日 | 20140305 |
| 法律状态 | 公开 |
| 法律状态信息 | 公开 |
 权利要求
权利要求
权利要求数量(3)
独立权利要求数量(1)
1.一种酶标抗体试剂,其特征在于包括组分1、组分2和组分3,各组分原料含量如下:
组分1中含有pH为6.0的醋酸盐缓冲液1-10mmol/L,过碘酸钠0.05-0.5mol/L,过氧化脲0.5-1g/L,三乙醇胺0.1-1mL/L;
组分2中含有无水碳酸钠63.6 g/L,碳酸氢钠33.6g/L;
组分3中含有硼氢化钠4g/L,甘氨酸2 g/L,甘油1mL/L。
2.根据权利要求1所述的酶标抗体试剂,其特征在于各组分原料含量如下:
组分1中含有pH为6.0的醋酸盐缓冲液5mmol/L,过碘酸钠0.1mol/L,过氧化脲0.5g/L,三乙醇胺1mL/L;
组分2中含有无水碳酸钠63.6 g/L,碳酸氢钠33.6g/L;
组分3中含有硼氢化钠4g/L,甘氨酸2 g/L,甘油1mL/L。
3.根据权利要求1所述的酶标抗体试剂,其特征在于称取5mg辣根过氧化物酶溶解于1mL 组分1中,37℃恒温孵育60分钟,加入200μL 组分2,同时加入10mg需要标记的抗体,37℃恒温孵育30分钟,再加入100μL 组分3,37℃恒温孵育30分钟,得到酶标记抗体。
1.一种酶标抗体试剂,其特征在于包括组分1、组分2和组分3,各组分原料含量如下:
组分1中含有pH为6.0的醋酸盐缓冲液1-10mmol/L,过碘酸钠0.05-0.5mol/L,过氧化脲0.5-1g/L,三乙醇胺0.1-1mL/L;
组分2中含有无水碳酸钠63.6 g/L,碳酸氢钠33.6g/L;
组分3中含有硼氢化钠4g/L,甘氨酸2 g/L,甘油1mL/L。
2.根据权利要求1所述的酶标抗体试剂,其特征在于各组分原料含量如下:
组分1中含有pH为6.0的醋酸盐缓冲液5mmol/L,过碘酸钠0.1mol/L,过氧化脲0.5g/L,三乙醇胺1mL/L;
组分2中含有无水碳酸钠63.6 g/L,碳酸氢钠33.6g/L;
组分3中含有硼氢化钠4g/L,甘氨酸2 g/L,甘油1mL/L。
3.根据权利要求1所述的酶标抗体试剂,其特征在于称取5mg辣根过氧化物酶溶解于1mL 组分1中,37℃恒温孵育60分钟,加入200μL 组分2,同时加入10mg需要标记的抗体,37℃恒温孵育30分钟,再加入100μL 组分3,37℃恒温孵育30分钟,得到酶标记抗体。
 说明书
说明书
技术领域
本发明涉及临床体外检测试剂技术领域,特别涉及一种酶标抗体试剂。
背景技术
背景技术
1971年Engvall和Perlmann发表了酶联免疫吸附剂测定(enzyme linked immunosorbent assay,elisA)用于IgG定量测定的文章,使得1966年开始用于抗原定位的酶标抗体技术发展成液体标本中微量物质的测定方法。这一方法的基本原理是:①使抗原或抗体结合到某种固相载体表面,并保持其免疫活性。②使抗原或抗体与辣根过氧化物酶(HRP)连接成酶标抗原或抗体,这种酶标抗原或抗体既保留其免疫活性,又保留酶的活性。在测定时,把受检标本(测定其中的抗体或抗原)和酶标抗原或抗体按不同的步骤与固相载体表面的抗原或抗体起反应。用洗涤的方法使固相载体上形成的抗原抗体复合物与其他物质分开,最后结合在固相载体上的酶量与标本中受检物质的量成一定的比例。加入辣根过氧化物酶(HRP)反应的底物液后,底物被酶催化变为有色产物,产物的量与标本中受检物质的量直接相关,故可根据颜色反应的深浅刊物定性或定量分析。由于酶的催化频率很高,故可极大地地放大反应效果,从而使测定方法达到很高的敏感度。
酶标记物包括酶标记抗原、酶标记抗体和酶标记SPA等。酶标记物质量的好坏直接关系到免疫酶技术的成功与否,因此被称为关键的试剂。酶标记物中最常用的是酶标记抗体,它是将酶与特异性抗体经适当方法连接而成。酶标记抗体的质量主要取决于纯度好、活性强及亲和力高的酶和抗体,其次要有良好的制备方法。目前,高质量的酶(如辣根过氧化物酶,简称HRP)国内已有商品供应。高质量的抗体则可通过提取纯化而获得。在制备方法上,宜选用产率高、不影响结合物的活性和不混杂干扰性物质且操作简便易行的方法。
酶与抗体交联的方法有许多种,根据酶的结构不同可采用不同的方法。对于制备HRP结合物,可用戊二醛二步法和过碘酸钠法。尤以简易过碘酸钠法更为常用。
戊二醛二步法的原理:戊二醛为一种双功能试剂,通过其醛基分别与酶和免疫球蛋白上的氨基共价结合,形成酶-戊二醛-免疫球蛋白结合物。简易过碘酸钠法是以NaIO4先将HRP表面的糖分子氧化成醛基,然后再与Ig上的氨基相结合,所获酶标记抗体的产率高,将近70%的HRP和Ig结合,99%的Ig与酶结合,酶与Ig的活性无重大损失,是目前最常用的方法。
无论是戊二醛二步法还是简易过碘酸钠法,都需要对酶结合物进行纯化,去除游离的抗体和辣根过氧化物酶,操作步骤复杂繁琐,而且纯化的过程中易造成酶结合物的流失,增大成本,增加制备时间。同时梅标抗体所用的试剂都需要现配现用,不能长时间放置,这些都限制了酶联免疫法中酶标记物的制备。
发明内容
发明内容
针对于上述常规酶标抗体存在的问题,本发明提供一种稳定高效的酶标抗体试剂,保证试剂能在2~8℃条件下稳定放置1年,而且酶结合抗体后,不需要经过蛋白盐析、透析的过程,操作简单,整个酶标过程只需要2个小时就可以完成,节省了大量的制备时间。
本发明是通过以下措施实现的:
一种酶标抗体试剂,包括组分1、组分2和组分3,各组分原料含量如下:
组分1中含有pH为6.0的醋酸盐缓冲液1-10mmol/L,过碘酸钠0.05-0.5mol/L,过氧化脲0.5-1g/L,三乙醇胺0.1-1mL/L;
组分2中含有无水碳酸钠63.6 g/L,碳酸氢钠33.6g/L;
组分3中含有硼氢化钠4g/L,甘氨酸2 g/L,甘油1mL/L。
所述的酶标抗体试剂,各组分原料含量如下:
组分1中含有pH为6.0的醋酸盐缓冲液5mmol/L,过碘酸钠0.1mol/L,过氧化脲0.5g/L,三乙醇胺1mL/L;
组分2中含有无水碳酸钠63.6 g/L,碳酸氢钠33.6g/L;
组分3中含有硼氢化钠4g/L,甘氨酸2 g/L,甘油1mL/L。
所述的酶标抗体试剂,称取5mg辣根过氧化物酶溶解于1mL 组分1中,37℃恒温孵育60分钟,加入200μL 组分2,同时加入10mg需要标记的抗体,37℃恒温孵育30分钟,再加入100μL 组分3,37℃恒温孵育30分钟,得到酶标记抗体。
本发明的有益效果:
本发明提供的酶标记抗体试剂,直接对游离的抗体和HRP进行淬灭,不需要对酶结合物进行透析和纯化,直接可以应用到试剂盒中,不影响本底和检测结果;将常规标记流程中的过夜(18小时)降低到了2小时完成,大大节省了反应时间;将试剂放置到2~8℃和37℃环境中,试剂能稳定长期保存,稳定性良好,可以长久应用。
附图说明
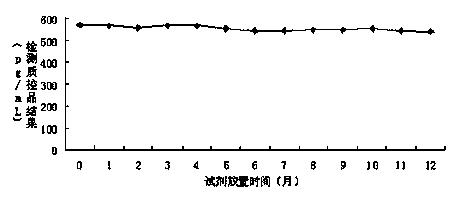
图1 实施例3试剂放置在2~8℃条件下的稳定性曲线,
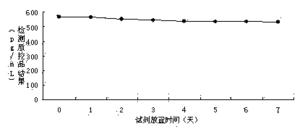
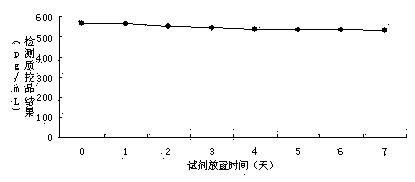
图2实施例3试剂放置在37℃条件下的稳定性曲线。
具体实施方式
为了更好的理解本发明,下面结合具体实施例来进一步说明。
实施例1:酶标抗体试剂组分及浓度为
组分1(R1):
pH为6.0的醋酸盐缓冲液 1mmol/L
过碘酸钠 0.05mol/L
过氧化脲 0.5g/L
三乙醇胺 0.1mL/L
溶于蒸馏水中制备完成;
组分2(R2):
无水碳酸钠 63.6 g/L
碳酸氢钠 33.6g/L
溶于蒸馏水中制备完成;
组分3(R3):
硼氢化钠 4g/L
甘氨酸 2 g/L
甘油 1mL/L
将甘油溶于蒸馏水中,然后加入甘氨酸和硼氢化钠进行溶解。
酶标抗体试剂的应用流程为:称取5mgHRP溶解于1mL R1组分中,37℃恒温孵育60分钟,加入200μL R2组分,同时加入10mg需要标记的抗体,37℃恒温孵育30分钟,再加入100μL R3组分,37℃恒温孵育30分钟。此时酶标记抗体的工作已经完成,将酶结合物加入到1L的0.1M PH7.4 PBS缓冲液中,即得抗HCV单抗-HRP 酶结合物。
实施例2:酶标抗体试剂组分及浓度为
组分1(R1):
pH为6.0的醋酸盐缓冲液 5mmol/L
过碘酸钠 0.1mol/L
过氧化脲 0.5g/L
三乙醇胺 1mL/L
溶于蒸馏水中制备完成;
组分2(R2):
无水碳酸钠 63.6 g/L
碳酸氢钠 33.6g/L
溶于蒸馏水中制备完成;
组分3(R3):
硼氢化钠 4g/L
甘氨酸 2 g/L
甘油 1mL/L
将甘油溶于蒸馏水中,然后加入甘氨酸和硼氢化钠进行溶解。
使用方法同实施例1。
实施例3:酶标抗体试剂组分及浓度为
组分1(R1):
pH为6.0的醋酸盐缓冲液 10mmol/L
过碘酸钠 0.5mol/L
过氧化脲 1g/L
三乙醇胺 1mL/L
溶于蒸馏水中制备完成;
组分2(R2):
无水碳酸钠 63.6 g/L
碳酸氢钠 33.6g/L
溶于蒸馏水中制备完成;
组分3(R3):
硼氢化钠 4g/L
甘氨酸 2 g/L
甘油 1mL/L
将甘油溶于蒸馏水中,然后加入甘氨酸和硼氢化钠进行溶解。
使用方法同实施例1。
酶标抗体活性验证:
利用丙型肝炎核心抗原检测试剂盒(双抗夹心ELISA)对制备的酶结合物进行检测验证。具体操作步骤为:(1)设定好加样孔,将50μL系列HCV定标品加在HCV试剂盒的包被板上,平行加入两组,再分别加入50μL试剂盒自带抗HCV单抗-HRP 酶结合物,以及用实施例1、实施例2、实施例3试剂制备的抗HCV单抗-HRP 酶结合物,37℃反应 1 小时后,洗板 5 次,拍干;(2)每孔加入显色液 A 液和 B 液各 50uL,避光 37℃显色 15min。(3)每孔加入终止液各 50uL,用酶标仪在波长 450nm/630nm 处读取吸光度(OD)值。使用丙肝核心抗原试剂盒作为对比。检测结果如表1所示:
表1 检测结果
标准品浓度(pg/mL) 丙肝核心抗原试剂盒测定OD值 实施例1酶结合物测定OD值 实施例2酶结合物测定OD值 实施例3酶结合物测定OD值 0 0.070 0.072 0.074 0.069 10 0.243 0.265 0.274 0.257 100 1.052 1.126 1.152 1.075 1000 1.695 1.742 1.813 1.673 10000 2.232 2.342 2.464 2.205 100000 2.648 2.769 2.835 2.603 相关系数 1 0.9998 0.9997 0.9999
上述相关系数,均为与丙肝核心抗原试剂盒相比。
测定0浓度时的OD值为本底强度,通过实验测定结果,应用实施例1、实施例2、实施例3制备的酶结合物检测本底为0.070左右,与丙肝核心抗原试剂盒原始酶结合物检测的本底强度几乎一致,因此,应用本发明试剂制备的酶结合物虽然没有透析、纯化,但是没有影响到试剂盒的检测本底。分别对比各个浓度检测的OD值,实施例1、实施例2、实施例3酶结合物检测结果与试剂盒原始的酶结合物对照的相关系数分别为0.9998、0.9997和0.9999,结果十分相近,说明实施例1、实施例2、实施例3制备的酶结合物准确度高。
酶标抗体试剂稳定性验证:
将实施例3的酶标抗体试剂,按照产品包装规格(R1 50mL,R2 10mL, R3 5mL)分为20等份,其中13份放置2~8℃冰箱中,每月定时取出一组,按照操作流程对丙型肝炎核心抗原抗体(HCV-cAb)进行酶标记处理;另外7份放置于37℃恒温箱中,每天取出一组,按照操作流程对丙型肝炎核心抗原抗体(HCV-cAb)进行酶标记处理。流程为:称取5mgHRP溶解于1mL R1组分中,37℃恒温孵育60分钟,加入200μL R2组分,同时加入10mg 丙型肝炎核心抗原抗体(HCV-cAb),37℃恒温孵育30分钟,再加入100μL R3组分,37℃恒温孵育30分钟。此时酶标记抗体的工作已经完成,将酶结合物加入到1L的0.1M PH7.4 PBS缓冲液中。
利用丙型肝炎核心抗原检测试剂盒(双抗夹心ELISA)对制备的酶结合物进行检测,检测流程为(1)设定好加样孔,将50μL系列HCV定标品和质控品(理论值为563pg/mL)加在HCV试剂盒的包被板上,再分别加入50μL用实施例3试剂制备的抗HCV单抗-HRP 酶结合物,37℃反应 1 小时后,洗板 5 次,拍干;(2)每孔加入显色液 A 液和 B 液各 50uL,避光 37℃显色 15min。(3)每孔加入终止液各 50uL,用酶标仪在波长 450nm/630nm 处读取吸光度(OD)值。检测结果如图1、图2所示。
经过稳定性验证,实施例3配制的试剂,在经过2~8℃放置1年或37℃放置7天后,处理的酶结合物依然能够达到要求的结果,说明试剂能够稳定放置。
本发明提供一种稳定高效的酶标抗体试剂,制备酶结合抗体后,不需要经过蛋白盐析、透析的过程,操作简单,整个酶标过程只需要2个小时就可以完成,节省了大量的制备时间,同时试剂能在2~8℃条件下稳定放置1年,37℃稳定放置7天。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受实施例的限制,其它任何未背离本发明的精神实质与原理下所做的改变、修饰、组合、替代、简化均应为等效替换方式,都包含在本发明的保护范围之内。
 价值度评估
价值度评估
技术价值
经济价值
法律价值
0 0 061.0分
0 50 75 100专利价值度是通过科学的评估模
型对专利价值进行量化的结果,
基于专利大数据针对专利总体特
征指标利用计算机自动化技术对
待评估专利进行高效、智能化的
分析,从技术、经济和法律价值
三个层面构建专利价值评估体
系,可以有效提升专利价值评估
的质量和效率。
总评:61.0分
该专利价值中等 (仅供参考)
本专利文献中包含【1 个技术分类】,从一定程度上而言上述指标的数值越大可以反映出所述专利的技术保护及应用范围越广。 【专利权的维持时间12 年】专利权的维持时间越长,其价值对于权利人而言越高。 尤其重要是,该专利 【权利质押5 次】、 都从侧面反应出该专利的技术、经济和法律价值。
技术价值 29.0
该指标主要从专利申请的著录信息、法律事件等内容中挖掘其技术价值,专利类型、独立权利要求数量、无效请求次数等内容均可反映出专利的技术性价值。 技术创新是专利申请的核心,若您需要进行技术借鉴或寻找可合作的项目,推荐您重点关注该指标。
部分指标包括:
授权周期(发明)
16 个月独立权利要求数量
0 个从属权利要求数量
0 个说明书页数
5 页实施例个数
0 个发明人数量
3 个被引用次数
0 次引用文献数量
0 个优先权个数
0 个技术分类数量
1 个无效请求次数
0 个分案子案个数
0 个同族专利数
0 个专利获奖情况
无保密专利的解密
否经济价值 10.0
该指标主要指示了专利技术在商品化、产业化及市场化过程中可能带来的预期利益。 专利技术只有转化成生产力才能体现其经济价值,专利技术的许可、转让、质押次数等指标均是其经济价值的表征。 因此,若您希望找到行业内的运用广泛的热点专利技术及侵权诉讼中的涉案专利,推荐您重点关注该指标。
部分指标包括:
申请人数量
1申请人类型
企业许可备案
0 次权利质押
5 次权利转移
0 个海关备案
否法律价值 22.0
该指标主要从专利权的稳定性角度评议其价值。专利权是一种垄断权,但其在法律保护的期间和范围内才有效。 专利权的存续时间、当前的法律状态可反映出其法律价值。故而,若您准备找寻权属稳定且专利权人非常重视的专利技术,推荐您关注该指标。
部分指标包括:
存活期/维持时间
12法律状态
有权-审定授权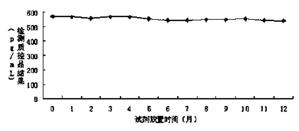








 苏公网安备 32041202001399号
苏公网安备 32041202001399号



 loading...
loading...