【中国发明,中国发明授权】一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方法
无权-未缴年费 中国
- 申请号:
- CN201310215492.1
- 专利权人:
- 上海市第六人民医院
- 授权公告日/公开日:
- 2016.12.07
- 专利有效期:
- 2013.05.31-2033.05.31
- 技术分类:
- A61:医学或兽医学;卫生学
- 转化方式:
- 转让
- 价值度指数:
-
- 57.0分
- 价格:
- 面议
- 专利信息&法律状态
- 专利自评
- 专利技术文档
- 价值度指数
- 发明人阵容
 著录项
著录项
- 申请号
- CN201310215492.1
- 申请日
- 20130531
- 公开/公告号
- CN104208684A
- 公开/公告日
- 20141217
- 申请/专利权人
- [上海市第六人民医院]
- 发明/设计人
- [姜立新, 胡兵]
- 主分类号
- A61K41/00
- IPC分类号
- C12N 9/0008(2013.01) C12N 9/16
- CPC分类号
- C12N 9/0008(2013.01) C12N 9/16(2013.01)
- 分案申请地址
- 国省代码
- 上海(31)
- 颁证日
- G06T1/00
- 代理人
- [冯子玲]
 摘要
摘要
本发明公开了一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方法,包括制备生物素化脂质氟碳纳米粒;制备生物素化尼妥珠单克隆抗体;制备靶向EGFR氟碳纳米粒。采用本方法所制备靶向EGFR脂膜氟碳纳米粒表面光滑呈球形,颗粒规则无粘连,粒径在200~500nm之间,可与胰腺癌肿瘤细胞表面的EGFR特异性结合,能够在聚焦超声作用下发生液气相的转变,增强聚焦超声的疗效;本发明合成的产物能够与肿瘤细胞表面EGFR特异性结合,并可在超声作用下发生液气相转变并破裂,其产生的空化效应可以损伤肿瘤血管内皮细胞,并对肿瘤细胞起到抑制和杀伤作用,从而达到对聚焦超声治疗的增效作用。
 法律状态
法律状态
| 法律状态公告日 | 20240621 |
| 法律状态 | 专利权的终止 |
| 法律状态信息 | 未缴年费专利权终止 IPC(主分类):A61K 41/00 专利号:ZL2013102154921 申请日:20130531 授权公告日:20161207 终止日期: |
| 法律状态公告日 | 20161207 |
| 法律状态 | 授权 |
| 法律状态信息 | 授权 |
| 法律状态公告日 | 20150107 |
| 法律状态 | 实质审查的生效 |
| 法律状态信息 | 实质审查的生效 IPC(主分类):A61K 41/00 申请日:20130531 |
| 法律状态公告日 | 20141217 |
| 法律状态 | 公开 |
| 法律状态信息 | 公开 |
 权利要求
权利要求
权利要求数量(9)
独立权利要求数量(6)
1.一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方法,其特征在于,包括 以下步骤:
(1)制备生物素化脂质氟碳纳米粒:
a、将二棕榈酰磷脂酰胆碱DPPC、二棕榈酰基磷脂酸DPPA、生物素化 DSPE-PEG2000-BIOTIN,按照质量比为50:2:5的比例加至丙二醇中,搅拌加热,70℃下上述 脂质混合物溶解,脂质混合物的质量浓度为0.5%~0.6%;
b、当脂质混合物溶解后,逐滴加入体积比为8:1的生理盐水与甘油的混合溶液,生理盐 水与甘油的混合溶液与丙二醇体积相同;
c、将步骤b得到的脂质混合溶液与全氟戊烷C 5F 12按体积比3:1混合,匀化处理制得粒径 为200~500nm的生物素化脂质氟碳纳米粒;
(2)制备生物素化尼妥珠单克隆抗体:
d、将长臂生物素酯NHS-LC-BIOTIN以1mg/ml溶于二甲基亚砜DMSO中,尼妥珠单克隆 抗体以lmg/ml溶于PBS缓冲液中;
e、按摩尔比30:1将NHS-LC-BIOTIN和尼妥珠单克隆抗体混合,并在室温下轻晃反应1h, 使抗体与生物素酯充分交联;
f、将步骤e中的混合液移至滤膜管,将滤膜管放置于高速离心机中离心去除未结合的 NHS-LC-BIOTIN,滤膜管内存留的即为生物素化尼妥珠单克隆抗体;
(3)制备靶向EGFR氟碳纳米粒:
g、将步骤(1)制备得到的生物素化脂质氟碳纳米粒加入PBS溶液中稀释后,缓慢滴加 到亲和素SA溶液中,亲和素SA溶液中亲和素SA与DSPE-PEG2000-BIOTIN等摩尔量,在恒温 振荡器中缓慢振摇充分孵育;
h、将经过孵育的纳米粒混悬液离心去除上清液以除去游离的SA,然后加入PBS缓冲液 漂洗,重复离心去除上清液至少三次;
i、将亲和素、生物素化脂质氟碳纳米粒及生物素化尼妥珠单克隆抗体三者按照等摩尔比 进行混合,避光以缓慢振摇充分孵育后,最终获得携带EGFR单克隆抗体的靶向氟碳纳米粒。
2.根据权利要求1所述的一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方 法,其特征在于,所述步骤c中匀化处理的方法为超声乳化法,超声波的输出功率为30~50W, 时间30秒。
5.根据权利要求1所述的一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方 法,其特征在于,所述步骤f中,高速离心机以5000r/min的速度离心10min,共2次。
9.根据权利要求1所述的一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方 法,其特征在于,所述靶向氟碳纳米粒的粒径为200~500nm。
3.根据权利要求1所述的一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方 法,其特征在于,所述步骤c中匀化处理的方法为高压均质机法,高速电动分散机搅拌,转 速1000~1200转/分,进行乳化5~10min,最后将混合溶液转入高压均质机内60~80Mpa乳 化5min即可。
4.根据权利要求1所述的一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方 法,其特征在于,所述步骤f中滤膜管为PLTK微孔滤膜管。
6.根据权利要求1所述的一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方 法,其特征在于,所述步骤g中,将生物素化脂质氟碳纳米粒加入到2mlPBS溶液中稀释后, 缓慢滴加到8ml亲和素SA溶液中,亲和素SA溶液中的亲和素SA与DSPE-PEG2000-BIOTIN等 摩尔量,混合溶液在恒温振荡器中4℃、避光以35r/min缓慢振摇充分孵育30min;
7.根据权利要求1所述的一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方 法,其特征在于,所述步骤h中,在4℃下以速度1000rpm离心3min。
8.根据权利要求1所述的一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方 法,其特征在于,所述步骤i中,避光以35r/min缓慢振摇充分孵育30分钟。
1.一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方法,其特征在于,包括以下步骤:
(1)制备生物素化脂质氟碳纳米粒:
a、将二棕榈酰磷脂酰胆碱DPPC、二棕榈酰基磷脂酸DPPA、生物素化DSPE-PEG2000-BIOTIN,按照质量比为50:2:5的比例加至丙二醇中,搅拌加热,70℃下上述脂质混合物溶解,脂质混合物的质量浓度为0.5%~0.6%;
b、当脂质混合物溶解后,逐滴加入体积比为8:1的生理盐水与甘油的混合溶液,生理盐水与甘油的混合溶液与丙二醇体积相同;
c、将步骤b得到的脂质混合溶液与全氟戊烷C5F12按体积比3:1混合,匀化处理制得粒径为200~500nm的生物素化脂质氟碳纳米粒;
(2)制备生物素化尼妥珠单克隆抗体:
d、将长臂生物素酯NHS-LC-BIOTIN以1mg/ml溶于二甲基亚砜DMSO中,尼妥珠单克隆抗体以lmg/ml溶于PBS缓冲液中;
e、按摩尔比30:1将NHS-LC-BIOTIN和尼妥珠单克隆抗体混合,并在室温下轻晃反应1h,使抗体与生物素酯充分交联;
f、将步骤e中的混合液移至滤膜管,将滤膜管放置于高速离心机中离心去除未结合的NHS-LC-BIOTIN,滤膜管内存留的即为生物素化尼妥珠单克隆抗体;
(3)制备靶向EGFR氟碳纳米粒:
g、将步骤(1)制备得到的生物素化脂质氟碳纳米粒加入PBS溶液中稀释后,缓慢滴加到亲和素SA溶液中,亲和素SA溶液中亲和素SA与DSPE-PEG2000-BIOTIN等摩尔量,在恒温振荡器中缓慢振摇充分孵育;
h、将经过孵育的纳米粒混悬液离心去除上清液以除去游离的SA,然后加入PBS缓冲液漂洗,重复离心去除上清液至少三次;
i、将亲和素、生物素化脂质氟碳纳米粒及生物素化尼妥珠单克隆抗体三者按照等摩尔比进行混合,避光以缓慢振摇充分孵育后,最终获得携带EGFR单克隆抗体的靶向氟碳纳米粒。
2.根据权利要求1所述的一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方法,其特征在于,所述步骤c中匀化处理的方法为超声乳化法,超声波的输出功率为30~50W,时间30秒。
3.根据权利要求1所述的一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方法,其特征在于,所述步骤c中匀化处理的方法为高压均质机法,高速电动分散机搅拌,转速1000~1200转/分,进行乳化5~10min,最后将混合溶液转入高压均质机内60~80Mpa乳化5min即可。
4.根据权利要求1所述的一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方法,其特征在于,所述步骤f中滤膜管为PLTK微孔滤膜管。
5.根据权利要求1所述的一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方法,其特征在于,所述步骤f中,高速离心机以5000r/min的速度离心10min,共2次。
6.根据权利要求1所述的一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方法,其特征在于,所述步骤g中,将生物素化脂质氟碳纳米粒加入到2mlPBS溶液中稀释后,缓慢滴加到8ml亲和素SA溶液中,亲和素SA溶液中的亲和素SA与DSPE-PEG2000-BIOTIN等摩尔量,混合溶液在恒温振荡器中4℃、避光以35r/min缓慢振摇充分孵育30min;
7.根据权利要求1所述的一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方法,其特征在于,所述步骤h中,在4℃下以速度1000rpm离心3min。
8.根据权利要求1所述的一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方法,其特征在于,所述步骤i中,避光以35r/min缓慢振摇充分孵育30分钟。
9.根据权利要求1所述的一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方法,其特征在于,所述靶向氟碳纳米粒的粒径为200~500nm。
 说明书
说明书
技术领域
本发明涉及一种氟碳纳米粒的制备方法,尤其涉及的是一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方法。
背景技术
氟碳纳米粒是一种新兴的纳米级超声造影剂,其平均直径为200-400nm,核心是不同沸点的液态氟碳化合物,外层由脂质或多聚体包裹。与气态氟碳类微米级造影剂相比,具有更强的组织穿透力,更长的组织内循环时间及更加持久的抵抗外界压力和机械应力变化等优点。靶向氟碳纳米超声造影剂是将特异性抗体、配体连接于氟碳纳米粒表面,使其能主动结合到靶组织或靶器官相应的受体上。研究表明,表面装配有表皮生长因子受体EGFR单克隆抗体的主动性靶向超声造影剂能够与肿瘤细胞的EGFR特异性结合,减少受体与配体结合引起的磷酸化,干扰EGFR介导的信号传导通路,从而促进胰腺癌细胞凋亡,抑制肿瘤生长。
液态氟碳能够在超声作用下转变为气态,具有独特的ADV(acoustic droplet vaporize,声致相变微粒汽化)现象。肿瘤血管内的氟碳纳米粒在超声作用下转变成为纳米微泡,聚焦超声与微泡作用所产生的空化效应可以导致肿瘤微血管壁破裂,毛细血管内皮细胞间隙增宽,通透性增加,从而使靶向氟碳纳米粒更容易通过肿瘤血管内皮间隙进入肿瘤间质与肿瘤细胞结合,增加对肿瘤细胞的抑制和杀伤作用。肿瘤间质中的载药氟碳纳米粒则可在超声作用下汽化,并在物理靶向作用下破裂,产生的声孔效应和空化效应可以增加对肿瘤细胞的杀伤作用,弥补了微米级靶向氟碳造影剂只能局限于血管内的不足。由于肿瘤血管内的氟碳纳米粒转变成为氟碳微泡,相互融合可以阻塞微血管,造成肿瘤内部缺氧环境,可进一步增强聚焦超声疗效。聚焦超声靶区内的氟碳纳米粒可迅速转变为纳米气泡发挥增效作用,靶区外的相转变过程则进行缓慢,故对靶区外组织的损伤并不增加,保证了聚焦超声治疗的精确性和安全性。
发明内容
本发明的目的在于克服现有技术的不足,提供了一种用于增强聚焦超声疗效的靶向EGFR氟碳纳米粒的制备方法,不仅解决了普通氟碳纳米粒主动靶向性差的问题,而且通过聚焦超声介导其所含液态氟碳发生液气相的转变并破裂,实现对聚焦超声治疗的增效作用。
本发明是通过以下技术方案实现的:本发明包括以下步骤:
(1)制备生物素化脂质氟碳纳米粒:
a、将二棕榈酰磷脂酰胆碱DPPC、二棕榈酰基磷脂酸DPPA、生物素化DSPE-PEG2000-BIOTIN,按照质量比为50:2:5的比例加至丙二醇中,搅拌加热,70℃下上述脂质混合物溶解,脂质混合物的质量浓度为0.5%~0.6%;
b、当脂质混合物溶解后,逐滴加入体积比为8:1的生理盐水与甘油的混合溶液,生理盐水与甘油的混合溶液与丙二醇体积相同;
c、将步骤b得到的脂质混合溶液与全氟戊烷C5F12按体积比3:1混合,匀化处理制得粒径为200~500nm的生物素化脂质氟碳纳米粒;
(2)制备生物素化尼妥珠单克隆抗体:
d、将长臂生物素酯NHS-LC-BIOTIN以1mg/ml溶于二甲基亚砜DMSO中,尼妥珠单克隆抗体以lmg/ml溶于PBS缓冲液中;
e、按摩尔比30:1将NHS-LC-BIOTIN和尼妥珠单克隆抗体混合,并在室温下轻晃反应1h,使抗体与生物素酯充分交联;
f、将步骤e中的混合液移至滤膜管,将滤膜管放置于高速离心机中离心去除未结合的NHS-LC-BIOTIN,滤膜管内存留的即为生物素化尼妥珠单克隆抗体;
(3)制备靶向EGFR氟碳纳米粒:
g、将步骤(1)制备得到的生物素化脂质氟碳纳米粒加入PBS溶液中稀释后,缓慢滴加到亲和素SA溶液中,亲和素SA溶液中亲和素SA与DSPE-PEG2000-BIOTIN等摩尔量,在恒温振荡器中缓慢振摇充分孵育;
h、将经过孵育的纳米粒混悬液离心去除上清液以除去游离的SA,然后加入PBS缓冲液漂洗,重复离心去除上清液至少三次;
i、将亲和素、生物素化脂质氟碳纳米粒及生物素化尼妥珠单克隆抗体三者按照等摩尔比进行混合,避光以缓慢振摇充分孵育后,最终获得携带EGFR单克隆抗体的靶向氟碳纳米粒。
作为本发明的优选方式之一,所述步骤c中匀化处理的方法为超声乳化法,超声波的输出功率为30~50W,时间30秒。
作为本发明的优选方式之一,所述步骤c中匀化处理的方法为高压均质机法,高速电动分散机搅拌,转速1000~1200转/分,进行乳化5~10min,最后将混合溶液转入高压均质机内60~80Mpa乳化5min即可。
作为本发明的优选方式之一,所述步骤f中滤膜管为PLTK微孔滤膜管。
作为本发明的优选方式之一,所述步骤f中,高速离心机以5000r/min的速度离心10min,共2次。
作为本发明的优选方式之一,所述步骤g中,将生物素化脂质氟碳纳米粒加入到2mlPBS溶液中稀释后,缓慢滴加到8ml亲和素SA溶液中,亲和素SA溶液中的亲和素SA与DSPE-PEG2000-BIOTIN等摩尔量,混合溶液在恒温振荡器中4℃、避光以35r/min缓慢振摇充分孵育30min;
作为本发明的优选方式之一,所述步骤h中,在4℃下以速度1000rpm离心3min。
作为本发明的优选方式之一,所述步骤i中,避光以35r/min缓慢振摇充分孵育30分钟。
所述靶向氟碳纳米粒的粒径为200~500nm,制备得到的氟碳纳米粒的尺寸合格。
本发明相比现有技术具有以下优点:本方法是一种制备靶向载药氟碳纳米粒的简单方法,采用本方法所制备靶向EGFR脂膜氟碳纳米粒表面光滑呈球形,颗粒规则无粘连,粒径在200~500nm之间,可与胰腺癌肿瘤细胞表面的EGFR特异性结合,能够在聚焦超声作用下发生液气相的转变,增强聚焦超声的疗效;本发明的方法操作简单,条件温和,合成的产物能够与肿瘤细胞表面EGFR特异性结合,并可在超声作用下发生液气相转变并破裂,其产生的空化效应可以损伤肿瘤血管内皮细胞,并对肿瘤细胞起到抑制和杀伤作用,从而达到对聚焦超声治疗的增效作用。所制备的靶向EGFR脂膜氟碳纳米粒具有稳定性好、生物相容好、特异性强的特点。
附图说明
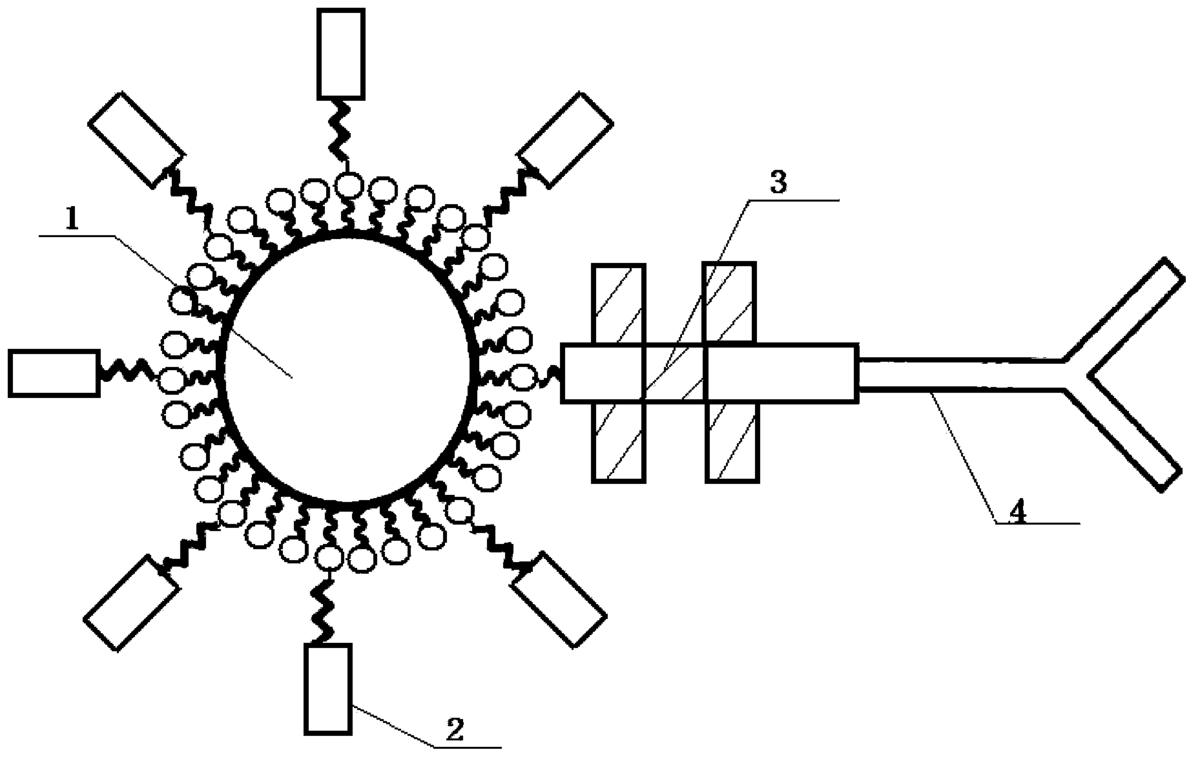
图1是本发明制得的靶向氟碳纳米粒的结构示意图;
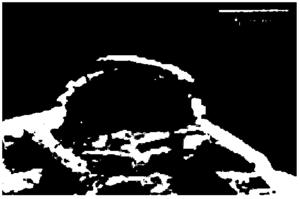
图2是氟碳纳米粒放大3000倍时扫描电镜的靶向氟碳纳米粒形貌图;
图3是氟碳纳米粒放大10000倍时扫描电镜的靶向氟碳纳米粒形貌图;
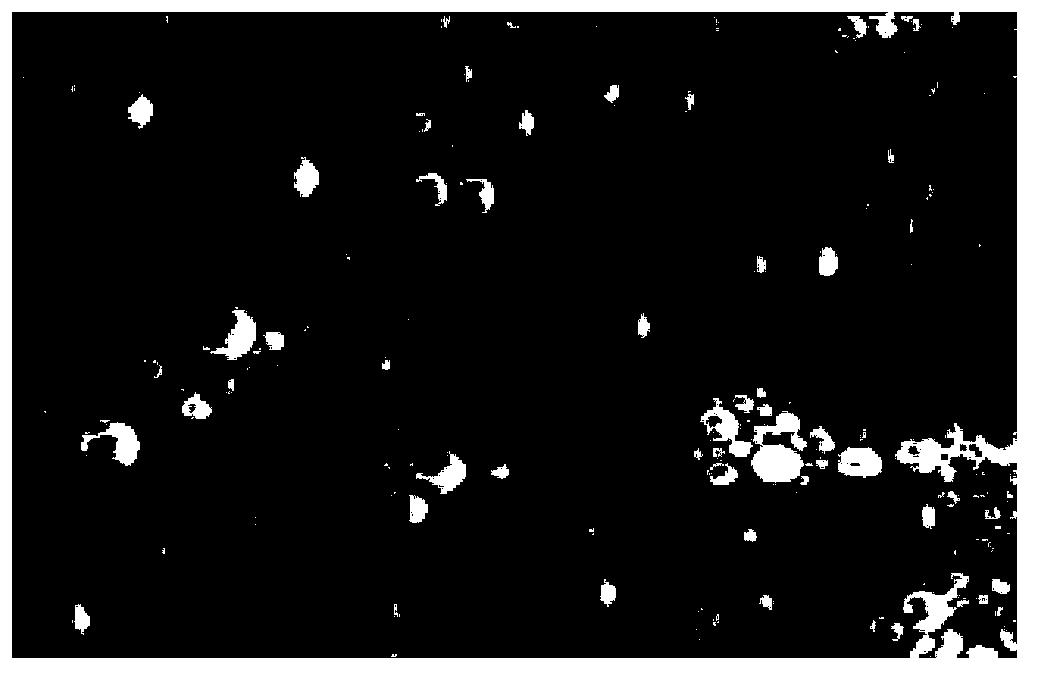
图4DAPI标记的人BXPC-3胰腺癌细胞核在激光共聚焦荧光显微镜下的示意图;
图5是荧光素Cy3标记的靶向氟碳纳米粒在激光共聚焦荧光显微镜下的示意图;
图6是靶向氟碳纳米粒围绕在细胞核周围在激光共聚焦荧光显微镜下的示意图;
图7是对照组聚焦超声照射前的肿瘤示意图;
图8是对照组肿瘤聚焦超声照射后的示意图;
图9是试验组聚焦超声照射前的肿瘤示意图;
图10是试验组肿瘤聚焦超声照射后的示意图。
具体实施方式
下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
实施例1
(1)将二棕榈酰磷脂酰胆碱DPPC、二棕榈酰基磷脂酸DPPA、生物素化DSPE-PEG2000-BIOTIN三种物质共8.55mg,按照质量比为50:2:5的比例加至1.5ml丙二醇中,搅拌加热,70℃下上述脂质混合物溶解,当脂质溶解后逐滴加入1.5ml体积比为8:1的生理盐水与甘油的混合溶液。将250μl全氟戊烷C5F12加至750μl的脂质混合溶液,将此混合溶液放在冰盒中使用连续波超声乳化,输出功率为50W,时间30秒,得到粒径为200~300nm的生物素化脂质氟碳纳米粒。
(2)然后将NHS-LC-BIOTIN以1mg/ml溶于DMSO中,尼妥珠单克隆抗体以lmg/ml溶于PBS缓冲液中,按摩尔比30:1将NHS-LC-BIOTIN和尼妥珠单克隆抗体混合,并在室温下轻晃反应1h,使抗体与生物素酯充分交联,而后移至PLTK微孔滤膜管,将滤膜管放置于高速离心机中以5000r/min离心10min,共2次,去除未结合的NHS-LC-BIOTIN,滤膜管内存留的即为生物素化尼妥珠单克隆抗体。
(3)将亲和素、生物素化脂质氟碳纳米粒及生物素化尼妥珠单克隆抗体三者按照等摩尔比进行混合,避光以35r/min缓慢振摇充分孵育30分钟,最终获得携带EGFR单克隆抗体、粒径为200~300nm的靶向氟碳纳米粒。
实施例2
(1)将二棕榈酰磷脂酰胆碱DPPC、二棕榈酰基磷脂酸DPPA、生物素化DSPE-PEG2000-BIOTIN三种物质共8.55mg,按照质量比为50:2:5的比例加至1.5ml丙二醇中,搅拌加热,70℃下上述脂质混合物溶解,当脂质慢慢溶解后逐滴加入1.5ml体积比为8:1的生理盐水与甘油的混合溶液。将250μl全氟戊烷C5F12加至750μl的脂质混合溶液,将此混合溶液放在冰盒中使用连续波超声乳化,输出功率为30W,时间25秒,得到粒径为400~500nm的生物素化脂质氟碳纳米粒。
(2)然后将NHS-LC-BIOTIN以1mg/ml溶于DMSO中,尼妥珠单克隆抗体以lmg/ml溶于PBS缓冲液中,按摩尔比30:1将NHS-LC-BIOTIN和尼妥珠单克隆抗体混合,并在室温下轻晃反应1h,使抗体与生物素酯充分交联,而后移至PLTK微孔滤膜管,将滤膜管放置于高速离心机中以5000r/min离心10min,共2次,去除未结合的NHS-LC-BIOTIN,滤膜管内存留的即为生物素化尼妥珠单克隆抗体。
(3)将亲和素、生物素化脂质氟碳纳米粒及生物素化尼妥珠单克隆抗体三者按照等摩尔比进行混合,避光以35r/min缓慢振摇充分孵育30分钟,最终获得携带EGFR单克隆抗体、粒径为400~500nm的靶向氟碳纳米粒。
实施例3
(1)将二棕榈酰磷脂酰胆碱DPPC、二棕榈酰基磷脂酸DPPA、生物素化DSPE-PEG2000-BIOTIN三种物质共8.55mg,按照质量比为50:2:5的比例加至1.5ml丙二醇中,搅拌加热,70℃下上述脂质混合物溶解,当脂质慢慢溶解后逐滴加入1.5ml体积比为8:1的生理盐水与甘油的混合溶液。将250μl全氟戊烷C5F12加至750μl的脂质混合溶液,将1ml混合溶液加入高速电动分散机搅拌,转速为1200转/分,进行乳化10min,然后再将此混合溶液放入高压均质机内80Mpa下乳化5min得到粒径为200~300nm生物素化脂质氟碳纳米粒。
(2)然后将NHS-LC-BIOTIN以1mg/ml溶于DMSO中,尼妥珠单克隆抗体以lmg/ml溶于PBS缓冲液中,按摩尔比30:1将NHS-LC-BIOTIN和尼妥珠单克隆抗体混合,并在室温下轻晃反应1h,使抗体与生物素酯充分交联,而后移至PLTK微孔滤膜管,将滤膜管放置于高速离心机中以5000r/min离心10min,共2次,去除未结合的NHS-LC-BIOTIN,滤膜管内存留的即为生物素化尼妥珠单克隆抗体。
(3)将亲和素、生物素化脂质氟碳纳米粒及生物素化尼妥珠单克隆抗体三者按照等摩尔比进行混合,避光以35r/min缓慢振摇充分孵育30分钟,最终获得携带EGFR单克隆抗体、粒径为200~300nm的靶向氟碳纳米粒。
实施例4
(1)将二棕榈酰磷脂酰胆碱DPPC、二棕榈酰基磷脂酸DPPA、生物素化DSPE-PEG2000-BIOTIN三种物质共8.55mg,按照质量比为50:2:5的比例加至1.5ml丙二醇中,搅拌加热,70℃下上述脂质混合物溶解,当脂质慢慢溶解后逐滴加入1.5ml体积比为8:1的生理盐水与甘油的混合溶液。将250μl全氟戊烷C5F12加至750μl的脂质混合溶液,将1ml混合溶液加入高速电动分散机搅拌,转速1000转/分钟,进行乳化10min,然后再将此混合溶液放入高压均质机内60Mpa下乳化5min得到粒径为400~500nm生物素化脂质氟碳纳米粒。
(2)然后将NHS-LC-BIOTIN以1mg/ml溶于DMSO中,尼妥珠单克隆抗体以lmg/ml溶于PBS缓冲液中,按摩尔比30:1将NHS-LC-BIOTIN和尼妥珠单克隆抗体混合,并在室温下轻晃反应1h,使抗体与生物素酯充分交联,而后移至PLTK微孔滤膜管,将滤膜管放置于高速离心机中以5000r/min离心10min,共2次,去除未结合的NHS-LC-BIOTIN,滤膜管内存留的即为生物素化尼妥珠单克隆抗体。
(3)将亲和素、生物素化脂质氟碳纳米粒及生物素化尼妥珠单克隆抗体三者按照等摩尔比进行混合,避光以35r/min缓慢振摇充分孵育30分钟,最终获得携带EGFR单克隆抗体、粒径为400~500nm的靶向氟碳纳米粒。
如图1所示,本发明采用乳化法制备非靶向氟碳纳米粒,并利用生物素化PEG制备生物素化氟碳纳米粒;其次,将生物素化氟碳纳米粒中加入Cy3-SA,荧光素Cy3标记的链酶亲和素3,低温振荡孵育制成SA-生物素化氟碳纳米粒;最后,加入生物素化尼妥珠单克隆抗体4,再经低温孵育,高速离心洗涤即得到靶向EGFR的氟碳纳米粒。实施例1~4制得的氟碳纳米粒外壳成分为脂膜,内核为液态氟碳1(全氟戊烷,C5F12)。液态氟碳1外是生物素2,生物素化氟碳纳米粒中加入了亲和素3,纳米粒表面的靶向配体是表皮生长因子受体(EGFR)的单克隆抗体4(尼妥珠单克隆抗体),形成的靶向氟碳纳米粒不仅解决了普通氟碳纳米粒主动靶向性差的问题,而且通过超声介导其所含液态氟碳1发生液气相的转变并破裂,实现对聚焦超声治疗的增效作用。
图2是实施例1~4制得的氟碳纳米粒放大3000倍时扫描电镜的靶向氟碳纳米粒形貌图,图3是实施例1~4制得的氟碳纳米粒放大10000倍时扫描电镜的靶向氟碳纳米粒形貌图,从图中可以看出,采用本方法所制备靶向EGFR脂膜氟碳纳米粒表面光滑呈球形,较为光洁,颗粒规则无粘连,粒径在200~500nm之间。
图4为DAPI(4',6-二脒基-2-苯基吲哚,4',6-diamidino-2-phenylindole)标记的人BXPC-3胰腺癌细胞核在激光共聚焦荧光显微镜下的示意图,呈蓝色;图5为荧光素Cy3标记的靶向氟碳纳米粒在激光共聚焦荧光显微镜下的示意图,呈橘红色;图6为靶向氟碳纳米粒围绕在细胞核周围在激光共聚焦荧光显微镜下的示意图,可见大量的橘红色靶向氟碳纳米粒围绕在蓝色的细胞核周围。
采用聚焦超声照射裸鼠皮下移植瘤,对照组注射生理盐水,试验组注射靶向氟碳纳米粒。图7是对照组聚焦超声照射前的肿瘤示意图,图9是试验组聚焦超声照射前的肿瘤示意图,图7和图9上可见肿瘤内部呈低回声;图8是对照组肿瘤聚焦超声照射后的示意图,肿瘤内无明显回声变化;图10是试验组肿瘤聚焦超声照射后的示意图,肿瘤内因氟碳纳米粒在聚焦超声作用下发生液气相转变,氟碳纳米粒汽化转变为纳米微泡表现为高回声,氟碳纳米粒能够增强聚焦超声的疗效。
 价值度评估
价值度评估
技术价值
经济价值
法律价值
0 0 057.0分
0 50 75 100专利价值度是通过科学的评估模
型对专利价值进行量化的结果,
基于专利大数据针对专利总体特
征指标利用计算机自动化技术对
待评估专利进行高效、智能化的
分析,从技术、经济和法律价值
三个层面构建专利价值评估体
系,可以有效提升专利价值评估
的质量和效率。
总评:57.0分
该专利价值中等 (仅供参考)
本专利文献中包含【3 个技术分类】,从一定程度上而言上述指标的数值越大可以反映出所述专利的技术保护及应用范围越广。 【被引用次数1 次】专利被引次数越多越能能够体现出该专利在相关技术领域研发中所发挥的基础性作用,代表着专利公开的内容有更多的产业利用价值。 【专利权的维持时间11 年】专利权的维持时间越长,其价值对于权利人而言越高。
技术价值 32.0
该指标主要从专利申请的著录信息、法律事件等内容中挖掘其技术价值,专利类型、独立权利要求数量、无效请求次数等内容均可反映出专利的技术性价值。 技术创新是专利申请的核心,若您需要进行技术借鉴或寻找可合作的项目,推荐您重点关注该指标。
部分指标包括:
授权周期(发明)
42 个月独立权利要求数量
0 个从属权利要求数量
0 个说明书页数
5 页实施例个数
0 个发明人数量
2 个被引用次数
1 次引用文献数量
1 个优先权个数
0 个技术分类数量
3 个无效请求次数
0 个分案子案个数
0 个同族专利数
0 个专利获奖情况
无保密专利的解密
否经济价值 6.0
该指标主要指示了专利技术在商品化、产业化及市场化过程中可能带来的预期利益。 专利技术只有转化成生产力才能体现其经济价值,专利技术的许可、转让、质押次数等指标均是其经济价值的表征。 因此,若您希望找到行业内的运用广泛的热点专利技术及侵权诉讼中的涉案专利,推荐您重点关注该指标。
部分指标包括:
申请人数量
1申请人类型
机关团体许可备案
0 次权利质押
0 次权利转移
0 个海关备案
否法律价值 19.0
该指标主要从专利权的稳定性角度评议其价值。专利权是一种垄断权,但其在法律保护的期间和范围内才有效。 专利权的存续时间、当前的法律状态可反映出其法律价值。故而,若您准备找寻权属稳定且专利权人非常重视的专利技术,推荐您关注该指标。
部分指标包括:
存活期/维持时间
11法律状态
无权-未缴年费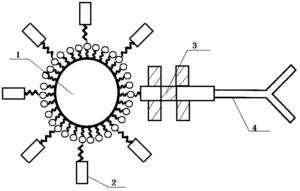






















 苏公网安备 32041202001399号
苏公网安备 32041202001399号



 loading...
loading...