【中国发明,中国发明授权】一种细菌表层黏附蛋白及其用途
无权-未缴年费 中国
- 申请号:
- CN200810207817.0
- 专利权人:
- 上海市第六人民医院
- 授权公告日/公开日:
- 2013.04.03
- 专利有效期:
- 2008.12.25-2028.12.25
- 技术分类:
- C07:有机化学〔2〕
- 转化方式:
- 转让
- 价值度指数:
-
- 54.0分
- 价格:
- 面议
- 专利信息&法律状态
- 专利自评
- 专利技术文档
- 价值度指数
- 发明人阵容
 著录项
著录项
- 申请号
- CN200810207817.0
- 申请日
- 20081225
- 公开/公告号
- CN101759781A
- 公开/公告日
- 20100630
- 申请/专利权人
- [上海市第六人民医院]
- 发明/设计人
- [沈通一, 秦环龙]
- 主分类号
- C07K14/195
- IPC分类号
- C12N 9/0008(2013.01) C12N 9/16
- CPC分类号
- C12N 9/0008(2013.01) C12N 9/16(2013.01)
- 分案申请地址
- 国省代码
- 上海(31)
- 颁证日
- G06T1/00
- 代理人
- [徐迅, 陈静]
 摘要
摘要
本发明涉及一种细菌表层黏附蛋白及其用途。本发明公开了一种整合膜蛋白STY的用途,用于制备促进细胞黏附的试剂。本发明还公开了利用所述整合膜蛋白STY改变细胞黏附特性的方法。本发明还公开了所述整合膜蛋白STY的特异性抗体。
 法律状态
法律状态
| 法律状态公告日 | 20240105 |
| 法律状态 | 专利权的终止 |
| 法律状态信息 | 未缴年费专利权终止 IPC(主分类):C07K 14/195 专利号:ZL2008102078170 申请日:20081225 授权公告日:20130403 终止日期: |
| 法律状态公告日 | 20130403 |
| 法律状态 | 授权 |
| 法律状态信息 | 授权 |
| 法律状态公告日 | 20120111 |
| 法律状态 | 实质审查的生效 |
| 法律状态信息 | 实质审查的生效 IPC(主分类):C07K 14/195 申请日:20081225 |
| 法律状态公告日 | 20100630 |
| 法律状态 | 公开 |
| 法律状态信息 | 公开 |
 权利要求
权利要求
权利要求数量(10)
独立权利要求数量(8)
1.一种整合膜蛋白的用途,用于制备促进细胞黏附的试剂。
2.如权利要求1所述的用途,其特征在于,所述的整合膜蛋白是:
(i)如SEQ ID NO:1中第455-755位所示氨基酸序列的蛋白;
(ii)如SEQ ID NO:1所示氨基酸序列的蛋白;
(iii)(i)或(ii)指定的氨基酸序列经过一个或多个氨基酸残基的取代、缺失或添加而形成的,且具有促进细胞黏附功能的由(i)或(ii)衍生的蛋白。
3.一种分离的蛋白,其特征在于,所述的蛋白是:
(a)如SEQ ID NO:1中第455-755位所示氨基酸序列的蛋白;
(b)(a)指定的氨基酸序列经过一个或多个氨基酸残基的取代、缺失或添加而形成的,且具有促进细胞黏附功能的由(a)衍生的蛋白。
4.一种分离的多核苷酸,其特征在于,所述的多核苷酸编码权利要求3所述的蛋白。
5.一种质粒载体,其特征在于,它含有权利要求4所述的多核苷酸。
6.一种遗传工程化的宿主细胞,其特征在于,它含有权利要求5所述的载体;或其基因组中整合有权利要求4所述的多核苷酸。
7.一种促进细胞黏附的方法,其特征在于,所述方法包括:使所述细胞重组表达整合膜蛋白。
8.一种抑制细胞黏附的方法,其特征在于,所述方法包括:利用特异性结合整合膜蛋白的抗体处理所述的细胞,从而封闭细胞中的整合膜蛋白。
9.一种抗体,其特征在于,所述的抗体特异性地结合所述的整合膜蛋白。
10.如权利要求9所述的抗体,其特征在于,所述的抗体是如下制备的:用所述的整合膜蛋白免疫动物,从动物体内分离多克隆抗体。
1.一种整合膜蛋白的用途,用于制备促进细胞黏附的试剂。
2.如权利要求1所述的用途,其特征在于,所述的整合膜蛋白是:
(i)如SEQ ID NO:1中第455-755位所示氨基酸序列的蛋白;
(ii)如SEQ ID NO:1所示氨基酸序列的蛋白;
(iii)(i)或(ii)指定的氨基酸序列经过一个或多个氨基酸残基的取代、缺失或添加而形成的,且具有促进细胞黏附功能的由(i)或(ii)衍生的蛋白。
3.一种分离的蛋白,其特征在于,所述的蛋白是:
(a)如SEQ ID NO:1中第455-755位所示氨基酸序列的蛋白;
(b)(a)指定的氨基酸序列经过一个或多个氨基酸残基的取代、缺失或添加而形成的,且具有促进细胞黏附功能的由(a)衍生的蛋白。
4.一种分离的多核苷酸,其特征在于,所述的多核苷酸编码权利要求3所述的蛋白。
5.一种质粒载体,其特征在于,它含有权利要求4所述的多核苷酸。
6.一种遗传工程化的宿主细胞,其特征在于,它含有权利要求5所述的载体;或其基因组中整合有权利要求4所述的多核苷酸。
7.一种促进细胞黏附的方法,其特征在于,所述方法包括:使所述细胞重组表达整合膜蛋白。
8.一种抑制细胞黏附的方法,其特征在于,所述方法包括:利用特异性结合整合膜蛋白的抗体处理所述的细胞,从而封闭细胞中的整合膜蛋白。
9.一种抗体,其特征在于,所述的抗体特异性地结合所述的整合膜蛋白。
10.如权利要求9所述的抗体,其特征在于,所述的抗体是如下制备的:用所述的整合膜蛋白免疫动物,从动物体内分离多克隆抗体。
 说明书
说明书
技术领域
本发明属于生物技术领域,更具体地,本发明涉及一种细菌表层黏附蛋白及其用途。
背景技术
黏附是细菌与肠上皮细胞(IEC)相互作用的第一步,人肠道内含有500-1000种不同的微生物,尤其是结肠内细菌的数量达到1012/g粪便,面临着最高的细菌负荷。越来越多证据表明相对粪便内的其它细菌,只有能同肠粘膜紧密连接及黏附的细菌才能影响人类的健康。乳酸杆菌作为一种非侵袭性的细菌,其在肠道内的黏附、定植对抑制致病菌的定植、移位和感染,维护肠道黏膜屏障的完整性具有特别重要的意义。
目前认为乳酸杆菌可识别宿主表面特异受体,而宿主表面的蛋白、糖蛋白和糖脂可能就是受体,其黏附过程的第一步是非特异性的,由菌体结构所决定;第二步是在非特异性结合的基础上,菌体特异性配体进一步与宿主细胞相应的受体之间特异性的结合。该配体通常是存在于细菌表面或分泌至细胞外的黏附活性分子,不但可以介导细菌对靶细胞的黏着,激发继发于黏附的细胞内信号传导途径;并且通过竞争抑制等机制阻断具有类似配体结构的病原菌的黏附活性。近来研究较多的黏附分子包括脂磷壁酸(LTA)、细胞外多糖(EPS)、细胞表层蛋白等,其中细胞表层蛋白起着关键性的作用。
自从1994年Bernet MF在乳酸杆菌与致病菌之间对肠上皮细胞顶端受体竞争黏附实验中,提出黏附成分可能是细菌表面的不稳定蛋白质,据此研制了含冻干培养上清成分的活菌制剂,临床效果较单纯活菌为优,但黏附分子的本质未阐明(Bernet MF等,Lactobacillus acidophilus LA 1 binds to Culturedintestinal cell Lines and inhibits cell attachment cell invasion by enterovirulenbacteria.Gut,1994;35(4):483-9)。研究发现多种具有黏附特性的乳酸杆菌在通过化学及生物方法祛除或破坏表层蛋白后,其和宿主上皮的黏附能力也降低了。还有研究显示单用L.crispatus的表层蛋白提取物也可以达到抑制肠致病性大肠杆菌对宿主上皮细胞的黏附的效果。
由于表层的膜蛋白特有的亲疏水性结构所导致的生化纯化及结构功能分析的困难,使其相比可溶性蛋白,深入研究较少。受此影响,国内外对细菌如乳酸杆菌同肠上皮黏附过程中的起作用的靶蛋白的报道尚少。因此,本领域非常有必要进一步研究细菌的黏附机制,找到与黏附相关的蛋白或黏附机制,用于微生物的改良或良种筛选等。
发明内容
本发明的目的在于提供一种细菌表层黏附(又称为“粘附”)蛋白及其用途。
本发明的另一目的在于提供所述细菌表层黏附蛋白的特异性抗体。
在本发明的第一方面,提供一种整合膜蛋白的用途,用于制备促进细胞黏附的试剂。
在另一优选例中,所述的整合膜蛋白是:
(i)如SEQ ID NO:1中第455-755位所示氨基酸序列的蛋白;
(ii)如SEQ ID NO:1所示氨基酸序列的蛋白;
(iii)(i)或(ii)指定的氨基酸序列经过一个或多个(如1-20个;较佳的1-10个;更佳地1-5个)氨基酸残基的取代、缺失或添加而形成的,且具有促进细胞黏附功能的由(i)或(ii)衍生的蛋白。
在另一优选例中,所述的细胞是细菌细胞。
在另一优选例中,所述的细胞是乳酸菌细胞。
在另一优选例中,所述的促进细胞黏附是促进细胞在消化道(特别是肠道)上的黏附性能。特别是,所述的促进细胞黏附是促进细胞与消化道上皮细胞的黏附。
在本发明的第二方面,提供一种分离的蛋白,所述的蛋白是:
(a)如SEQ ID NO:1中第455-755位所示氨基酸序列的蛋白;
(b)(a)指定的氨基酸序列经过一个或多个(如1-20个;较佳的1-10个;更佳地1-5个)氨基酸残基的取代、缺失或添加而形成的,且具有促进细胞黏附功能的由(a)衍生的蛋白。
在本发明的第三方面,提供一种分离的多核苷酸,所述的多核苷酸编码所述的蛋白。
在另一优选例中,所述的多核苷酸是通过SEQ ID NO:12和SEQ ID NO:13所示序列的引物从植物乳酸菌CGMCC NO.1258基因组中扩增获得。
在本发明的第四方面,提供一种质粒载体,它含有所述的多核苷酸。
在本发明的第五方面,提供一种遗传工程化的宿主细胞,它含有所述的载体;或其基因组中整合有所述的多核苷酸。
在本发明的第六方面,提供一种所述的蛋白的制备方法,该方法包含:
(a)在适合表达的条件下,培养所述的宿主细胞;
(b)从培养物中分离出所述的蛋白。
在本发明的第七方面,提供一种促进细胞黏附的方法,所述方法包括:使所述细胞重组表达整合膜蛋白。
在本发明的第八方面,提供一种抑制细胞(如植物乳酸杆菌细胞)黏附的方法,所述方法包括:利用特异性结合整合膜蛋白的抗体处理所述的细胞,从而封闭细胞中的整合膜蛋白。
在本发明的第九方面,提供一种抗体,所述的抗体特异性地结合所述的整合膜蛋白。
在另一优选例中所述的整合膜蛋白是:
(i)如SEQ ID NO:1中第455-755位所示氨基酸序列的蛋白;
(ii)如SEQ ID NO:1所示氨基酸序列的蛋白;
(iii)(i)或(ii)指定的氨基酸序列经过一个或多个(如1-20个;较佳的1-10个;更佳地1-5个)氨基酸残基的取代、缺失或添加而形成的,且具有促进细胞黏附功能的由(i)或(ii)衍生的蛋白。
在另一优选例中,所述的抗体是如下制备的:用所述的整合膜蛋白免疫动物,从动物体内分离多克隆抗体。
在另一优选例中,所述的多克隆抗体如下制备:用纯化的所述的整合膜蛋白(优选地加入等体积的弗氏完全佐剂,充分乳化)免疫兔子(优选通过多点注射);免疫量600±200μg每只每次;初次免疫14±3天后,每14±3天用纯化的所述的整合膜蛋白加强免疫1次,免疫量是300±100μg每只每次,至少加强免疫2次;从兔血清中分离多克隆抗体。
本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
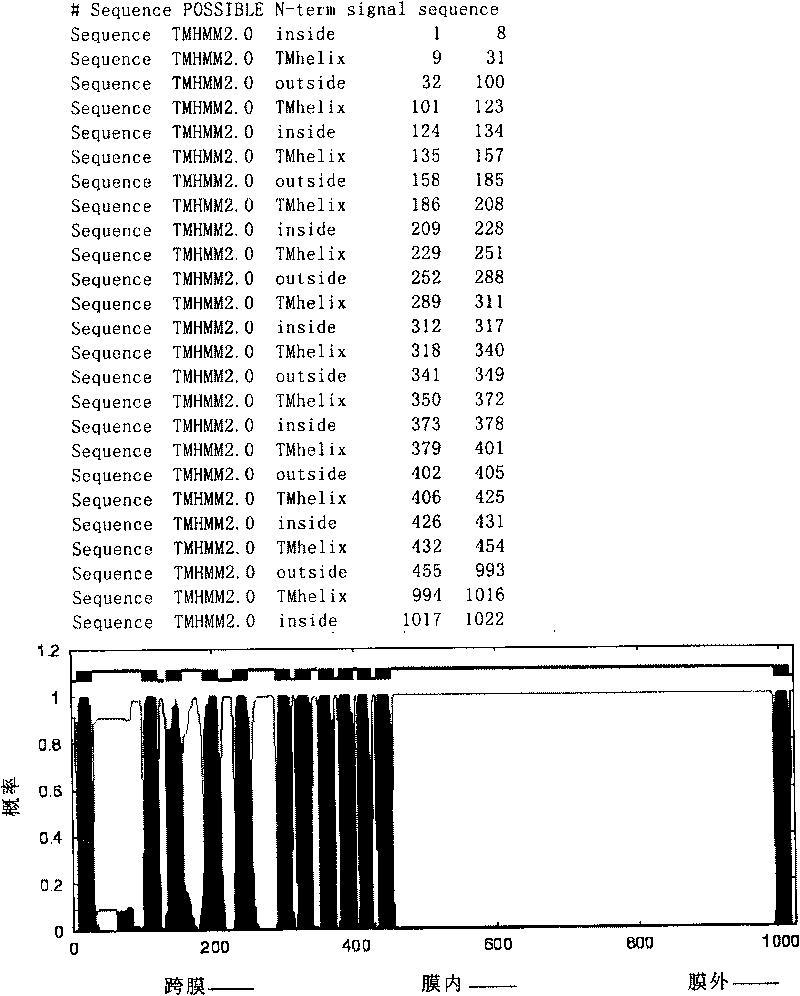
图1.整合膜蛋白序列分析(TMHMM2分析)。其中,红色区域为跨膜区域,紫色区域为膜外区域,蓝色为膜内区域。
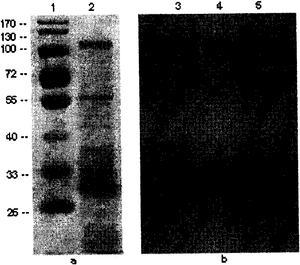
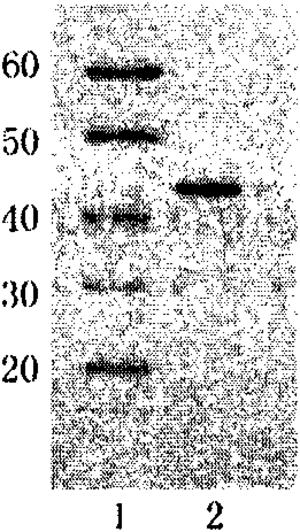
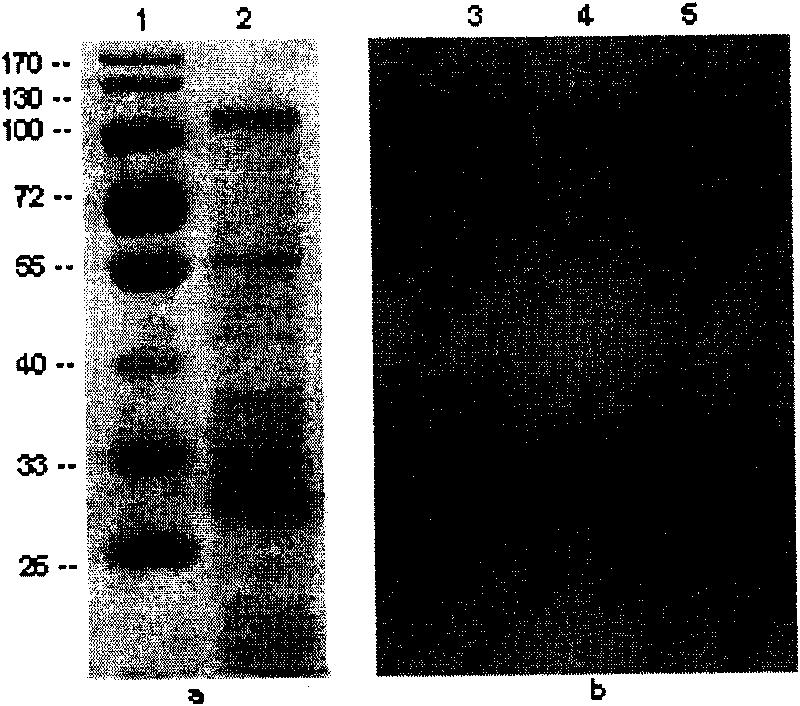
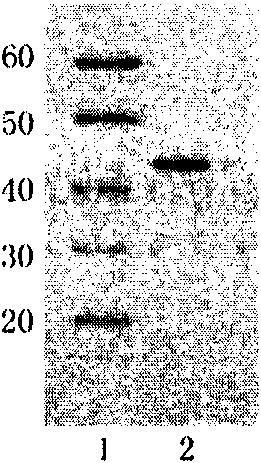
图2a.表层蛋白的SDS-PAGE电泳,其中,泳道1表示Marker蛋白电泳结果;泳道2表示表层蛋白电泳结果。
图2b.表层蛋白的Western印迹(泳道3,4,5)结果。
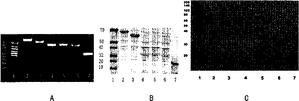
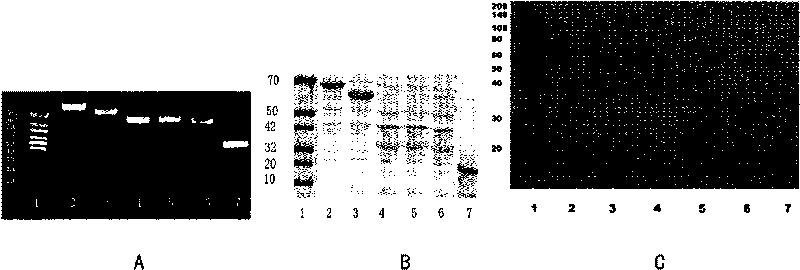
图3.表层黏附蛋白的表达和鉴定。
A.L plantarum CGMCC No1258目的基因的PCR扩增产物的电泳鉴定;其中,泳道1-7分别是Marker、PO、GBP、CD、IMP2、IMP3)、IMP1基因的电泳结果。
B.表达蛋白的SDS-PAGE电泳结果;其中,泳道1-7分别是Marker、GBP、PO、CD、IMP2、IMP3、IMP1蛋白的电泳结果。
C.Western印迹鉴定黏附蛋白(HRP-mucin)的结果;其中,泳道1-7分别是Marker、GBP、PO、CD、IMP2、IMP3、IMP1蛋白的印迹结果。
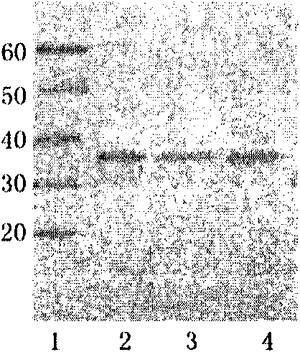
图4.Western鉴定抗IMP2抗体的灵敏度。其中,泳道1.Marker,泳道2.IMP2(1pg),泳道3.IMP2(10pg),泳道4.IMP2(100pg)。
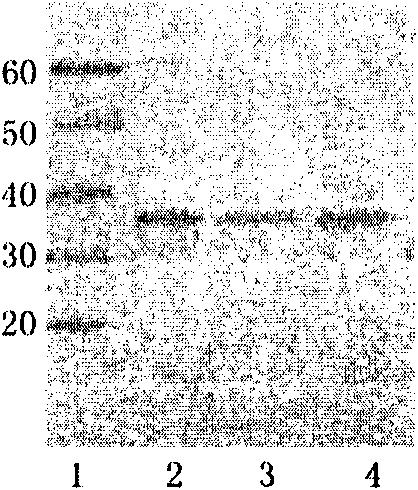
图5.通过Wetern印迹验证IMP2。其中泳道1为Marker,泳道2为全菌体黏附蛋白。
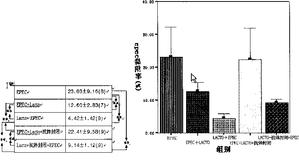
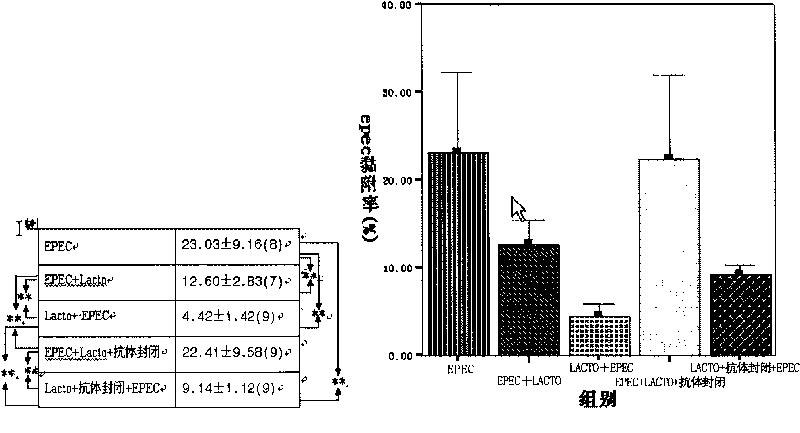
图6显示了各试验组的EPEC黏附率。
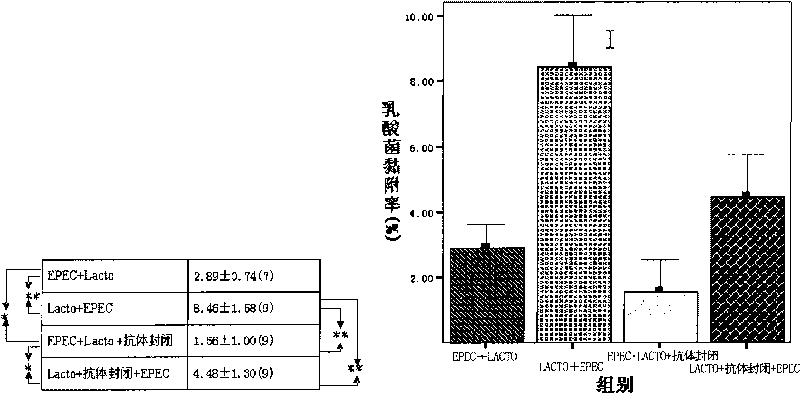
图7显示了各试验组的Lacto黏附率。
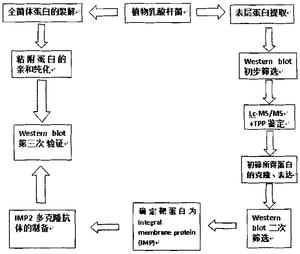
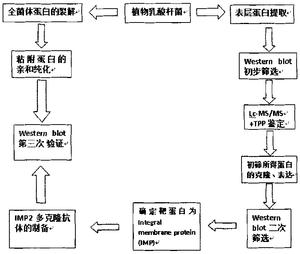
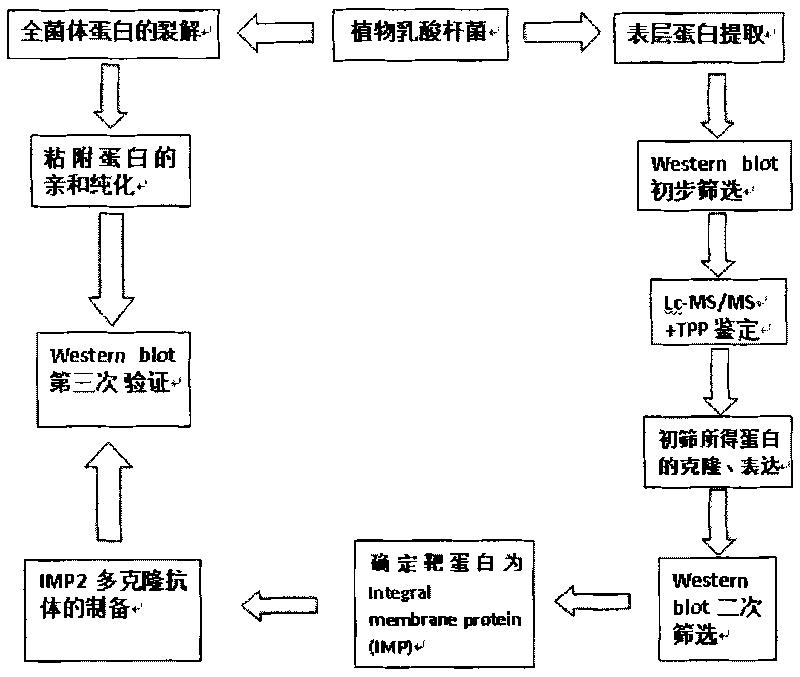
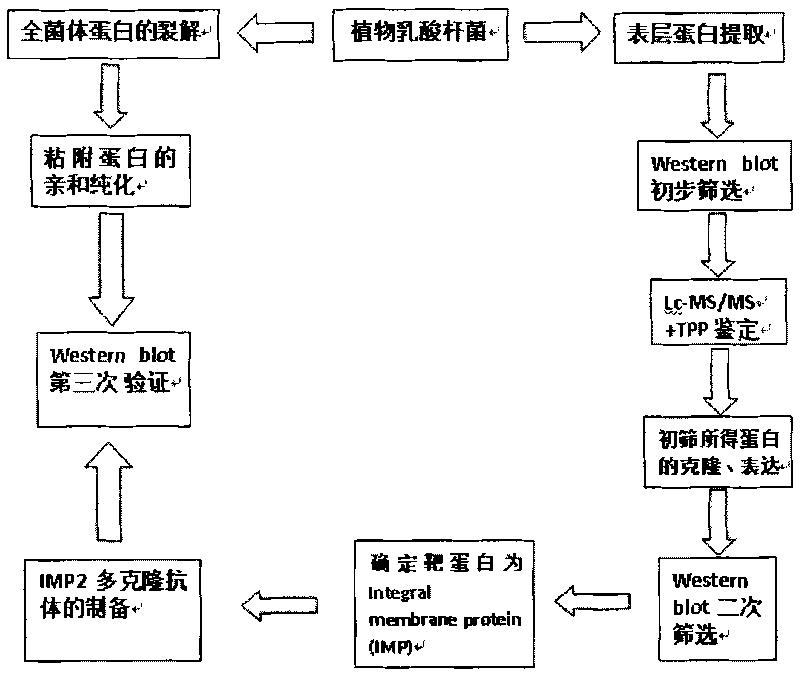
图8乳酸杆菌黏附蛋白的筛选过程。
具体实施方式
本发明人经过广泛而深入的研究,首次发现整合膜蛋白STY,特别是整合膜蛋白STY的IMP2段是一种有助于细胞黏附的蛋白片段。基于上述发现,可利用该蛋白来改变细胞的黏附性能,如使得有益菌重组表达该黏附蛋白以促进其肠道黏附性能,或利用特异性封闭该黏附蛋白的试剂来抑制表达该种黏附蛋白的有害菌的肠道黏附性能。
如本文所用,“分离的”是指物质从其原始环境中分离出来(如果是天然的物质,原始环境即是天然环境)。如活体细胞内的天然状态下的多聚核苷酸和多肽是没有分离纯化的,但同样的多聚核苷酸或多肽如从天然状态中同存在的其他物质中分开,则为分离纯化的。
如本文所用,所述的“含有”、“具有”或“包括”包括了“包含”、“主要由......构成”、“基本上由......构成”、和“由......构成”;“主要由......构成”、“基本上由......构成”和“由......构成”属于“含有”、“具有”或“包括”的下位概念。
如本文所用,抗体的“特异性”是指抗体能结合于所述的整合膜蛋白STY或蛋白片段;特别指那些能与哺乳动物整合膜蛋白STY或蛋白片段结合但不识别和结合于其它非相关抗原分子的抗体。
整合膜蛋白或其生物活性片段
在分析植物乳酸杆菌表层蛋白的过程中,本发明人首次分离出一种整合膜蛋白,并且经鉴定发现该整合膜蛋白是乳酸杆菌细胞发挥黏附作用的重要蛋白,本发明人将之命名为:整合膜蛋白STY。
在本发明中,所用的整合膜蛋白STY可以是天然存在的,比如其可被分离或纯化白哺乳动物。此外,所述的整合膜蛋白STY也可以是人工制备的,比如可以根据常规的基因工程重组技术来生产重组整合膜蛋白STY。优选的,本发明可采用重组的整合膜蛋白STY。
任何适合的整合膜蛋白STY均可用于本发明。所述的整合膜蛋白STY包括全长的整合膜蛋白STY或其生物活性片段(或称为活性片段)。较佳地,所述的整合膜蛋白STY的氨基酸序列可以与SEQ ID NO:1所示的序列基本上相同。
经过一个或多个氨基酸残基的取代、缺失或添加而形成的整合膜蛋白STY的氨基酸序列也包括在本发明中。整合膜蛋白STY或其生物活性片段包括一部分保守氨基酸的替代序列,所述经氨基酸替换的序列并不影响其活性或保留了其部分的活性。适当替换氨基酸是本领域公知的技术,所述技术可以很容易地被实施,并且确保不改变所得分子的生物活性。这些技术使本领域人员认识到,一般来说,在一种多肽的非必要区域改变单个氨基酸基本上不会改变生物活性。见Watson等Molecular Biology of The Gene,第四版,1987,TheBenjamin/Cummings Pub.Co.P224。
任何一种整合膜蛋白STY的生物活性片段都可以应用到本发明中。在这里,整合膜蛋白STY的生物活性片段的含义是指作为一种蛋白,其仍然能保持全长的整合膜蛋白STY的全部或部分功能。通常情况下,所述的生物活性片段至少保持50%的全长整合膜蛋白STY的活性。在更优选的条件下,所述活性片段能够保持全长整合膜蛋白STY的60%、70%、80%、90%、95%、99%、或100%的活性。
作为本发明的优选方式,所述的整合膜蛋白STY的生物活性片段具有SEQID NO:1中第455-755位所示氨基酸序列或其的蛋白。经验证,整合膜蛋白STY的上述生物活性片段是发挥黏附特性的关键性区域,该片段保留了全长整合膜蛋白STY的全部生物活性,甚至比全长整合膜蛋白STY具有更优异的生物活性。所述的整合膜蛋白STY的上述生物活性片段更易于被细胞重组表达。
一旦分离获得了所述蛋白的序列,就可以用重组法来大批量地获得该蛋白。这通常是将其编码基因克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到。此外,对于较短的蛋白而言,也可采用人工合成(如通过多肽合成仪合成)的方法来合成有关序列,人工合成的方法可简便且快速地得到所需要的蛋白。
本发明还包括了编码所述的整合膜蛋白STY的生物活性片段的分离的核酸,也可以是其互补链。编码整合膜蛋白STY的生物活性片段的DNA序列,可以全序列人工合成,也可用PCR扩增的方法获得。在获得了编码所述的整合膜蛋白STY的生物活性片段的DNA序列之后,将其连入合适的表达载体,再转入合适的宿主细胞。最后通过培养转化后的宿主细胞,通过分离纯化得到所要的蛋白。
本发明还包括了包含编码所述整合膜蛋白STY的生物活性片段的核酸分子的载体。所述的载体还可包含与所述核酸分子的序列操作性相连的表达调控序列,以便于蛋白的表达。所述的“操作性相连”或“可操作地连于”指这样一种状况,即线性DNA序列的某些部分能够调节或控制同一线性DNA序列其它部分的活性。例如,如果启动子控制序列的转录,那么它就是可操作地连于编码序列。
本领域的技术人员熟知的方法能用于构建含整合膜蛋白STY编码基因的序列和合适的转录/翻译控制信号的表达载体。这些方法包括体外重组DNA技术、DNA合成技术、体内重组技术等。所述的DNA序列可有效连接到表达载体中的适当启动子上,以指导mRNA合成。表达载体还包括翻译起始用的核糖体结合位点和转录终止子。
此外,含有编码所述整合膜蛋白STY的生物活性片段核酸序列的重组细胞也包括在本发明中。“宿主细胞”包括原核细胞和真核细胞。常用的原核宿主细胞包括大肠杆菌、枯草杆菌等;例如可为大肠杆菌细胞(E.coli),如大肠杆菌HMS174(DE3)、或BL21(DE3)。常用的真核宿主细胞包括酵母细胞、昆虫细胞和哺乳动物细胞。作为本发明的优选方式,所述的“宿主细胞”是一类有益菌(如益生菌)细胞,包括但不限于:乳酸菌细胞。
整合膜蛋白STY的用途
基于本发明人的新发现,本发明还提供了整合膜蛋白STY或其生物活性片段的用途,用于制备促进细胞黏附的试剂。
作为本发明的优选方式,所述的促进细胞黏附的方法包括:使所述细胞重组表达整合膜蛋白STY。在得知了所述的整合膜蛋白STY的氨基酸序列之后,本领域人员可以方便地制备重组表达整合膜蛋白STY的细胞,这通常是将整合膜蛋白STY的编码基因克隆入载体,再转入所述细胞。将外源的整合膜蛋白STY的编码基因导入到所述细胞内的方法是本领域人员熟知的。通常的方法是,获得编码所述的整合膜蛋白STY或其生物活性片段的基因序列,将其连入合适的表达载体,再转入细胞。更具体的步骤是:(i)提供一重组表达载体,该重组表达载体含有一基因表达盒,所述表达盒含有外源的整合膜蛋白STY或其生物活性片段的编码基因;(ii)将(i)的重组表达载体转化到细胞内,从而使得所述细胞内含有所述重组表达载体或者其基因组中整合有所述外源的整合膜蛋白STY。通过选择合适的表达载体,或者在表达载体上选择合适的启动子或增强子等以促进整合膜蛋白STY的表达是本领域人员熟知的。
由于全长的整合膜蛋白STY氨基酸序列特别长(含有多于1000个氨基酸),蛋白表达效率通常不如相对氨基酸序列较短的蛋白。因此,优选的是使细胞重组表达整合膜蛋白STY上决定黏附作用的关键区域。作为本发明的优选方式,使所述细胞重组表达具有整合膜蛋白STY的第455-755位氨基酸序列的蛋白,这将大大提高蛋白的表达效率。
当所述的细胞稳定地表达所述的整合膜蛋白STY后,所述的整合膜蛋白STY可起到促进细胞黏附,特别是促进细胞在肠道中黏附的作用。当所述的细胞是一种有益菌的细胞时,该有益菌在肠道中良好的黏附作用将有利于阻止一些肠道有害菌在肠道中的黏附,从而保障了肠道的健康。
当需要抑制一些有害菌(表达所述整合膜蛋白STY的有害菌)的细胞黏附作用是,所述方法通常包括:利用特异性封闭整合膜蛋白STY的试剂处理所述的细胞,从而封闭细胞中的整合膜蛋白STY。所述的特异性封闭整合膜蛋白STY的试剂优选地例如是特异性结合整合膜蛋白STY的抗体(包括单克隆抗体和多克隆抗体)。
结合整合膜蛋白STY的试剂
在得知了所述整合膜蛋白STY及其序列之后,可基于此来筛选或制备特异性封闭该整合膜蛋白STY的试剂,例如特异性结合整合膜蛋白STY的抗体。如利用所述整合膜蛋白STY制备一系列抗体,从这些抗体中找到结合特异性良好的可用于抑制整合膜蛋白STY,从而抑制相关细胞黏附作用的抗体。
在基于一些蛋白制备抗体的过程中,由于全长蛋白一般序列较长,制备特异性抗体的效率并不高,获得的抗体经常存在结合能力差、结合位点不确定等问题。因此需要针对相应蛋白找到其发挥相关作用的关键性位点,从而更有针对性地来制备抗体。因此,作为本发明的优选方式,基于整合膜蛋白STY上决定黏附作用的关键区域来设计结合整合膜蛋白STY的试剂。例如,以具有所述整合膜蛋白STY上第455-755位氨基酸序列的蛋白片段作为抗原,来制备特异性抗体。
所述的抗体可以通过本领域内技术人员已知的各种技术进行制备。例如,纯化的本发明的多肽可被施用于动物以诱导多克隆抗体的产生。与之相似的,表达本发明的多肽的细胞可用来免疫动物来生产抗体。本发明的抗体也可以是单克隆抗体。此类单克隆抗体可以利用杂交瘤技术来制备(见Kohler等人,Nature256;495,1975;Kohler等人,Eur.J.Immunol.6:511,1976;Kohler等人,Eur.J.Immunol.6:292,1976;Hammerling等人,In Monoclonal Antibodies andT Cell Hybridomas,Elsevier,N.Y.,1981)。多克隆抗体的生产可用本发明的多肽免疫动物,如家兔,小鼠,大鼠等。多种佐剂可用于增强免疫反应,包括但不限于弗氏佐剂等。
作为本发明的优选方式,本发明提供了一种多克隆抗体,所述的多克隆抗体特异性地结合所述的整合膜蛋白STY。所述的抗体是如下制备的:用所述的整合膜蛋白STY免疫动物,从动物体内分离多克隆抗体。更优选地,所述的多克隆抗体如下制备:用纯化的所述的整合膜蛋白STY(优选地加入等体积的弗氏完全佐剂,充分乳化)免疫兔子(优选通过多点注射);免疫量600±200μg每只每次;初次免疫14±3天后,每14±3天用纯化的所述的整合膜蛋白STY加强免疫1次,免疫量是300±100μg每只每次,至少加强免疫2次;从兔血清中分离多克隆抗体。所述的多克隆抗体特异性良好,对于整合膜蛋白STY具有优异的封闭效果,且对于整合膜蛋白STY以外的其它蛋白不发生交叉结合。
筛选调节细胞黏附的潜在物质的方法
在得知了所述的整合膜蛋白STY对于调节细胞黏附的用途后,可以基于该特征来筛选调节整合膜蛋白STY的表达或活性,从而调节细胞黏附作用的物质。
因此,本发明提供一种筛选可用于调节细胞黏附作用的潜在物质的方法,所述的方法包括:将候选物质与表达整合膜蛋白STY(或其生物活性片段,如具有整合膜蛋白STY第455-755位氨基酸序列的蛋白)的体系接触;和检测候选物质对整合膜蛋白STY的影响;若所述候选物质可提高整合膜蛋白STY的表达或活性,则表明该候选物质是可用于促进细胞黏附的潜在物质;若所述候选物质可降低整合膜蛋白STY的表达或活性,则表明该候选物质是可用于抑制细胞黏附的潜在物质。
在本发明的优选方式中,在进行筛选时,为了更易于观察到整合膜蛋白STY的表达或活性的改变,还可设置对照组,所述的对照组可以是不添加所述候选物质的表达整合膜蛋白STY的体系。
所述的体系包括(但不限于):溶液体系、亚细胞体系、细胞体系、组织体系、器官体系、或动物体系。
作为本发明的优选方式,所述的方法还包括:对获得的潜在物质进行进一步的细胞实验和/或动物试验,以进一步选择和确定对于调节细胞黏附作用真正有用的物质。
另一方面,本发明还提供了采用所述筛选方法获得的可用于调节细胞黏附的潜在物质。这些初步筛选出的物质可构成一个筛选库,以便于人们最终可以从中筛选出能够对于调节细胞黏附真正有用的物质。
本发明的主要优点在于:
(1)首次发现整合膜蛋白STY是一种有助于细胞黏附的蛋白,具有良好的促进细胞黏附的作用。
(2)首次鉴定出了所述整合膜蛋白STY上发挥黏附作用的关键区域,即该整合膜蛋白STY氨基酸序列的第455-755位,找到了抑制黏附的靶点,从而有利于设计特异性针对整合膜蛋白STY上该氨基酸区域的阻止黏附作用的试剂。
(3)利用所述的整合膜蛋白STY,可方便地改变特定细胞的黏附特性,产业应用价值不可估量。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如Sambrook等人,分子克隆:实验室指南(New York:Cold Spring Harbor Laboratory Press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
I.材料与方法
材料
植物乳酸杆菌(Lactobacillus plantarum CGMCC NO.1258)获自交大昂立微生物研究所。超速离心机购自Beckman公司。Mucin购自sigma公司。蛋白Marker及生物素标记Marker购自吉泰公司。表达质粒pET16b购自Novagen公司,并且通过常规方法在其多克隆位点添加了BglII和XhoI酶切位点。限制性内切酶、连接酶、及Taq DNA聚合酶和IPTG均购自MBI公司。质粒提取试剂盒、DNA凝胶回收试剂盒AXgen和HRP标记的山羊抗鼠IgG购于北京中杉生物工程公司。
植物乳酸杆菌的培养和表层蛋白的提取
将植物乳酸杆菌CGMCC NO.1258接种于新鲜配置的MRS液体培养基,37℃ 200转/hr培养24hr。将菌液3500g、4℃离心20min,去除上清,再用PBS混匀3500g,4℃离心20min,去除上清后加入2M盐酸胍室温200转/hr,3小时。将菌液6000g,4℃离心20min取上清液置半透膜内0.01M的PBS透析过夜,加入离心管放进4℃超速离心机40000g,离心60min,小心抽去上清。沉淀溶于0.1M的PBS,放于70℃恒温水槽孵育30min,16000g,4℃离心20min,上清液移出后即可进行后续Western印迹操作。
对黏蛋白作辣根过氧化酶(HRP)标记
根据Rojas.M的方法(Rojas M等;Purification and characterization of asurface protein from Lactobacillus fermentum 104R that binds to porcine smallintestinal mucus and gastric mucin.Appl Environ Microbiol2002;68(5):2330-6),取黏蛋白溶解于0.1mol/L碳酸盐缓冲液中(PH9.5),配置成4mg/ml的黏蛋白溶液。将辣根过氧化物酶(HRP)8mg溶解于2ml蒸馏水中,配置成HRP溶液,然后加入至400μl新鲜配置的0.1mol/L过碘酸钠溶液中,混合物室温下搅拌20min,然后置于0.001mol/L(PH4.4)乙酸盐缓冲液中,4℃透析过夜。取出透析后的HRP,加入0.1mol/L碳酸盐缓冲液中(PH9.5)20μl调节PH至9.0-9.5,取1ml黏蛋白和1ml HRP溶液混合,置于室温下混合搅拌2h,然后加入新鲜配置的4mg/L硼氢化钠溶液100μl以去除连接反应。混合液置于0.1mol/L(PH7.4)的硼酸缓冲液中4℃透析过夜,标记好的黏蛋白等体积加入80%甘油,-20℃保存。
表层蛋白的Western印迹分析
表达产物经SDS-PAGE电泳,采用10%分离胶和5%浓缩胶的不连续浓度梯度,恒压60V 30min,后改120V 90min。电泳完毕后,部分胶用考马斯亮蓝进行染色,另一部分胶移至电转膜仪上,100V 120min,用半干转移系统将蛋白转印至PVDF膜上,根据同细菌表面黏附蛋白可以同黏蛋白特异性结合的原理,加入1∶600稀释的HRP标记的粘蛋白作为抗体,同PVDF膜上的相关蛋白进行杂交,4℃孵育过夜,TBST洗膜3次,每次30分钟,ECL显色检测目的蛋白。
LC-MS/MS
根据Western印迹结果,选取PAGE胶上蛋白条带,通过液质联用(LC-MS/MS)测定氨基酸序列,并通过Sequest软件做初步分析。根据质谱分析的结果,通过蛋白质组学数据统计分析软件(Trans-proteomics Pipeline,TPP)软件包及FASTA软件进一步筛选分析相关蛋白。
初筛蛋白基因的克隆
MS结果发现相关蛋白可能是(1)A型GTP结合蛋白(GTP-Binding ProteinTypA,GBP);(2)丙酮酸氧化酶(Pyruvate Oxidase,PO);(3)细胞分裂激活蛋白(Cell Division initiation protein FtsQ,CD);(4)整合膜蛋白(Integral MenbraneProtein,IMP);(5)后期能力蛋白(Late Competence Protein,LCP)。分别对其进行克隆和表达(见表1);应用expasy(http://cn.expasy.org/)中的TMHMM工具,显示跨膜区。并根据蛋白质序列分析对整合膜蛋白的膜外部分作分段表达(见图1)。以Genbank中各蛋白对应的基因序列为模板,设计引物,通过PCR反应获取相应的基因产物。反应程序为基因组DNA经94℃变性3分钟;随后按94℃ 30秒,55℃ 30秒,72℃ 2分钟进行30个循环;最后72℃ 10分钟。PCR结束后1%琼脂糖电泳鉴定。
表1.PCR引物
基因名称 上游引物 下游引物 PO AtcagatctgATGGCAAAGATGATTGAAGC(SEQ ID NO:2) AtcctcgagCTATTCGACGTTGAACTCCT(SEQ ID NO:3) GBP AtcagatctgTTGAAATTTAGAGATGATAT(SEQ ID NO:4) AtcctcgagTTACTTGTTCATTTTACGCT(SEQ ID NO:5) CD AtcagatctgGTGGGTGTGATGGCCATTTT(SEQ ID NO:6) atcctcgag TCAATTATTCTGATTCTTGA(SEQ ID NO:7) LCP AtcagatctgGTGCTAGCATGCCTACTGTG(SEQ ID NO:8) AtcctcgagTTAACGTGCTAGCGTTAGCC(SEQ ID NO:9) IMP1 AtcagatctgTTGAAGACAGTACGGAAGAT(SEQ ID NO:10) AtcctcgagAATCGCAGCAAGATCAACGC(SEQ ID NO:11) IMP2 AtcagatctgAATACTAATTCTAATAGTAC(SEQ ID NO:12) AtcctcgagAAGATAGAGTTCCGTATTTC(SEQ ID NO:13) IMP3 AtcagatctgAAGCCAACCGTTACC AtcctcgagTTTTAGTCCTGGTGTG GGAAA(SEQ ID NO:14) TGAT(SEQ ID NO:15)
null
PCR产物经过AXgen胶试剂盒回收后,与原核表达载体pET16b同时用核酸内切酶BglII和XhoI酶切过夜,以T4连接酶连接,构建原核重组表达质粒。然后转化DH10B感受态,铺板,挑选单克隆培养,菌液PCR筛选阳性克隆的质粒进行测序,测序结果用在线程序BLAST进行比较。
初筛蛋白的表达
将测序正确的克隆抽质粒,转化BL21(DE3)感受态细胞,次日挑取菌落接种于含氨苄和氯霉素TB培养基,37℃ 200rpm下培养到OD值0.6时,加IPTG,并调整IPTG,终浓度为1mmol,诱导时间3小时,以期获得重组蛋白的表达。诱导结束,经离心收集细菌后,冰浴下超声裂解细菌。4℃、14000r/min离心10min分离上清。上清中加入His-Tag Fusion Protein Purification Beads(使用Talon的磁珠(Takara)),震荡30min纯化浓缩上清中的蛋白。
表达蛋白的Western印迹分析
Western印迹方法同前,纯化的蛋白经SDS-PAGE电泳,部分胶用考马斯亮蓝进行染色,另一部分胶转印至PVDF膜上,加入1∶600稀释的HRP标记的黏蛋白进行杂交,ECL显色检测目的蛋白。
表层黏附蛋白多克隆抗体制备
将确定的靶蛋白纯化,按常规方法免疫家兔。首次免疫时,按每只家兔600μg的剂量,将纯化得到的蛋白溶于PBS(终浓度为2g/L)中,加入等体积的弗氏完全佐剂,充分乳化后背部皮下及腹股沟多点注射;每点200μg乳化抗原。加强免疫,抗原用量为初次免疫的一半,加弗氏不完全佐剂,于前次免疫后的2周进行。最后1次加强免疫后的14天后放血,取血清。免疫血清用抗原亲和层析柱进行纯化,-20℃保存。
多克隆抗体鉴定
Western印迹(第二次)鉴定:方法同前,将1pg,10pg,100pg的纯化的重组蛋白作SDS-PAGE分离,转移到PVDF膜上,加入纯化后的兔抗IMP2多克隆抗体(1∶10000稀释),然后加入辣根过氧化物酶标记的羊抗兔二抗,ECL检测。
ELISA检测:将纯化的重组蛋白用PBS稀释至1mg/L,按照100μL/孔的量包被到聚苯乙烯反应(PVC)板上,4℃过夜包被;用PBST洗涤3次,然后按照200μL/孔的量加入封闭液;用PBST洗涤3次,每孔加入100μL倍比的免疫血清,同时设正常兔血清作为阴性对照,每个样品设2个复孔,37℃孵育2h;用PBST洗涤3次,每孔均加入100μL PBS(含1g/L BSA)稀释的二抗(辣根过氧化物酶标记的羊抗兔二抗,1∶5000稀释,Santa cruz),37℃孵育1h;用PBST洗涤3次,加入50μL OPD显色液,室温避光显色10~15min,用25μL 2mol/L的硫酸终止反应;在490nm波长下用酶标仪读数。
全菌体黏附蛋白的纯化
菌液离心后,先用PBS将细菌沉淀洗2-3遍,然后按10-50ml裂解液/1g湿菌体加入裂解液重悬菌体,裂解液的成分:50mM Tris-HCl,pH8.0,2mMEDTA,100mM NaCl,pH值8.5-9.0,加溶菌酶至100μg/ml,0.5%Triton X-100,1μl/ml的蛋白酶抑制剂PMSF。进行超声粉碎,超声功率300W,时间20min。离心后收取上清中的可溶性蛋白。蛋白溶液过空Sepharose 4B柱去除非特异结合的蛋白,蛋白溶液过粘蛋白连接的Sepharose 4B柱,柱上的黏附蛋白用20mM的1,3-二氨基丙烷(1,3-diaminopropane,DAP)洗脱而得到纯化的全菌体黏附蛋白。
Western印迹第三次验证
具体方法同前,将纯化全菌体黏附蛋白作SDS-PAGE电泳分离,转移到PVDF膜上,加入纯化后的兔抗IMP2多克隆抗体(1∶10000稀释),然后加入辣根过氧化物酶标记的羊抗兔二抗,ECL检测。
肠上皮细胞模型的建立
DMEM高糖液体培养基,另加10%胎牛血清,在5%CO2、饱和湿度、37℃条件下培养,当Caco-2细胞(购自中科院细胞所)生长至80~90%融合时,用0.25%胰酶+0.04%EDTA液消化细胞,按1∶3传代培养,实验所用细胞在10代以内。将细胞接种于12孔细胞培养板,生长至细胞成单层后进行实验。
乳酸杆菌和致病性大肠杆菌(EPEC)同Caco-2细胞的竞争黏附试验
分别将植物乳酸杆菌CGMCC NO.1258及EPEC(获自上海市疾病控制中心)根据比浊仪OD值调整菌液浓度至108/ml。加入到Caco-2细胞(37℃,5%CO2,95%湿度),并置于培养箱中孵育3hr,0.25%胰蛋白酶处理后,细菌与细胞的混合液经稀释后分别涂布于血琼脂平板(EPEC)和MRS琼脂平板(乳酸杆菌)培养,计数乳酸杆菌和EPEC的CFU。同时血球仪进行细胞计数。细菌黏附率=细菌数/细胞数。
(1)EPEC组:加入108/ml EPEC 0.1ml 3hr;
(2)EPEC+Lacto组:先加入108/ml EPEC 0.1ml 2hr,再加入108/ml Lacto0.1ml 1hr;
(3)Lacto+EPEC组:先加入108/ml Lacto 0.1ml 2hr,再加入108/ml EPEC0.1ml 1hr;
(4)EPEC+Lacto+抗体封闭组:先加入108/ml EPEC 0.1ml 2hr,再加入108/ml Lacto 0.1ml及500μg/ml抗IMP2抗体0.1ml 1hr;
(5)Lacto+抗体封闭+EPEC组:先加入108/ml Lacto 0.1ml及500μg/ml抗IMP2抗体0.1ml 2hr,再加入108/ml EPEC 0.1ml 1hr。
统计学处理
使用SAS9.1软件包分析数据,各组数据以表示,多组间的比较在总体满足正态分布,方差齐性的条件下采用单因素方差分析,在不满足正态分布,方差齐性条件下先对数据进行秩次转换然后采用单因素方差分析。多个实验组和一个对照组比较采用dunnet t检验,其他两组之间比较采用Student-Newman-Keuls(SNK)检验,α=0.05P<0.05表示差异有统计学意义。
I.实施例
实施例1.乳酸杆菌菌体表层黏附蛋白的鉴定
用盐酸胍结合超速离心法获得的表层蛋白并进行了SDS-PAGE电泳和western印迹,结果显示对照Marker可及在100-130KD、55KD、35-40KD、30-33KD等位置有多条条带(见图2a)。在PVDF膜的30KD处有一强阳性条带,黏附蛋白位于这条带中,见图2b。
实施例2.LC-MS/MS和数据分析
取PAGE胶的30KD处对应条带作LC-MS/MS及并用SEQUEST软件(Thermo Fisher Inc.)进行数据库检索分析以及ProteinProphet算法(Nesvizhskii,A.I.等,A statistical model for identifying proteins by tandem mass spectrometry.Analytical chemistry 2003;75:4646-4658)进行结果过滤。结果显示有5种蛋白同植物乳酸菌WCFS的蛋白库符合率达到90%,见表2。
表2.表达蛋白
编号 蛋白名称 PI Genbank登录号 表达途径 NO.1 丙酮酸氧化酶 5.0 ABC47131.1 全长 NO.2 细胞分裂激活蛋白 10.32 NP_785691.1 全长 NO.3 A型GTP-结合蛋白 5.12 NP_785653.1 全长 NO.4 后期能力蛋白 9.84 NP_784489.1 全长
编号 蛋白名称 PI Genbank登录号 表达途径 NO.5 整合膜蛋白 10.02 NP_785773.1 3段
其中,整合膜蛋白分为3段蛋白片段,分别称为IMP1(SEQ ID NO:1中第32-100位序列)、IMP2(SEQ ID NO:1中第455-755位序列)、IMP3(SEQ ID NO:1中第693-993位序列)。
实施例3.蛋白的克隆、表达和纯化
通过PCR对L.plantarum CGMCC No.1258的目标基因进行扩增。PCR产物电泳后在1%琼脂凝胶的1500bp-500bp位置呈现单根条带,其结果符合预期,见图3A。
PCR产物经琼脂糖凝胶电泳分离纯化后重组到PET-16B载体中。质粒转化感受态DH10B并测序。结果显示L.plantarum CGMCC No.1258的扩增基因同Genbank中的Lplantarum WSFC资料(GenBank登录号:NP_785773.1)一致。随后含有目的基因的质粒转染入E.coli BL21。IPTG诱导3hr。超声裂解细胞,His-tag Fusion Protein Purification Beads抽提纯化目的蛋白。蛋白洗脱后10%SDS-PAGE电泳分离(图3B)同时用HRP-mucin作抗体Western印迹分析(图3C)。
结果显示,所有目的蛋白表达量均占菌体总蛋白的90%以上。PVDF膜IMP2的30KD处有一相同形状的强阳性条带,即黏附蛋白,而其他蛋白未见阳性条带。Western印迹结果显示纯化的IMP2蛋白就是目的蛋白。
实施例4.黏附蛋白多克隆抗体的鉴定
Western印迹检测结果显示,重组蛋白IMP2免疫新西兰兔制备的多克隆抗体能很好地和IMP2特异性结合,即使是含量为1pg的IMP2在PVDF膜上也能够很好的分辨出来(图4)。采用间接ELISA法检测多克隆抗体的效价(表3)。
结果表明,本发明所获得的兔抗IMP2多克隆抗体用包被IMP2进行质量鉴定,效价为1∶2×106,OD值为1.186。
表3.间接法ELISA检测兔抗IMP2多克隆抗体效价
名称 阴性血清 空白对照 IMP2抗体 IMP2抗体 IMP2抗体 IMP2抗体 IMP2抗体 IMP2抗体 抗体稀释度 1/1000 1/1000 1/16k 1/64k 1/256k 1/512k 1/1024k 1/2048k OD值 0.023 0.021 2.772 2.635 2.58 2.218 1.799 1.186
实施例5.Western印迹对IMP2的验证
通过mucin-sepharose 4B column亲和纯化的全菌体黏附蛋白电泳后,用抗IMP2多克隆抗体作Western印迹分析,结果可见40-50bp有与理论相符的阳性条带(图5),这结果反映了IMP2存在于全菌体黏附蛋白中。
实施例6.乳酸杆菌(Lacto)和致病性大肠杆菌分别同Caco-2细胞的竞争黏附试验
致病性大肠杆菌(EPEC)同Caco-2的竞争黏附试验(图6A、B):(a)EPEC+Lacto、Lacto+EPEC及Lacto+抗体封闭+EPEC组平均EPEC黏附率比EPEC组低(P<0.01);(b)Lacto+EPEC的EPEC黏附率比EPEC+Lacto组低(P<0.01);(c)Lacto+抗体封闭+EPEC组的EPEC黏附率比与Lacto+EPEC组高(P<0.01),EPEC+Lacto+抗体封闭的EPEC黏附率较EPEC+Lacto组高(P<0.01);(d)EPEC+Lacto+抗体封闭与EPEC的比较差异无统计学意义。
乳酸杆菌(Lacto)同Caco-2的竞争黏附试验(图7A、B):(a)Lacto+EPEC组的Lacto黏附率比EPEC+Lacto,EPEC+Lacto+抗体封闭及Lacto+抗体封闭+EPEC组低(P<0.01);(b)EPEC+Lacto组Lacto黏附率比EPEC+Lacto+抗体封闭组高(P<0.05);(c)EPEC+Lacto+抗体封闭组Lacto黏附率比Lacto+抗体封闭+EPEC组低(P<0.05)。
讨论
本发明人将质谱分析结果同L.plantarum WCFS-1的蛋白库比对,并通过对相关蛋白的表达和筛选,在国际上首次发现植物乳酸菌CGMCC NO.1258表层存在着同肠道内粘蛋白黏附的整合膜蛋白(integral membrane protein,IMP),其氨基酸序列和L.plantarum WCFS-1的蛋白序列同源。本发明人通过生物信息学软件对质谱分析结果检索过滤,并对多种可能蛋白的表达纯化和鉴定,是一种基于生物信息学的新的黏附蛋白筛选和鉴定方法(图8),一方面本发明人在提取的表层蛋白中找到能与粘蛋白相作用的靶蛋白IMP2,并制备多克隆抗体,另一方面通过用粘蛋白sepharose4B柱获得纯化的全菌体黏附蛋白,用IMP2多克隆抗体在Western印迹中验证该全菌体黏附蛋白同前面获取的靶蛋白IMP2是一致的,这又进一步验证了前期的结果。多克隆抗体在封闭IMP2情况下,检测植物乳酸杆菌CGMCC NO.1258同EPEC竞争黏附肠上皮细胞进一步论证了IMP2在黏附过程中所起的作用,使实验结果更有说服力,对后续生物学分析和功能验证更有价值。
质谱分析技术(Mass spectrometry,MS)已经成为生命科学领域广泛应用和有效的分析方式。虽然具有高通量,大规模的特点,但数据的庞大也为它以后的分析和筛选带来了困难。利用SEQUEST软件(Thermo Fisher Inc.)进行质谱的数据库检索分析,得到样本中蛋白质成分,然后利用TPP(trans-proteomicpipeline)软件进行结果过滤,减小实验假阳性结果。通过该软件本发明人将原来83个蛋白缩减到了5个同源性达到90%以上的蛋白,精确了研究对象的范围。蛋白克隆表达过程中,本发明人利用pET16b在多克隆位点添加BglII和XhoI酶切位点以达到各个基因在同一个载体表达,相互作为参照,取得很好的效果,除LCP蛋白的表达量不高外,其它蛋白的表达量可达500μg/ml左右,而LCP蛋白没有高表达的原因尚需进一步探讨。由于IMP蛋白含有1000多个氨基酸,用常规方法作表达存在一定的困难,本发明人对其进行跨膜区域的分析(TMHMM软件(Schneider G等,Advances in the prediction of protein targetingsignals.Proteomics2004;4(6):1571-80;Do JH等,Computational approaches togene prediction.J Microbiol 2006;44(2):137-44)),发现N端100个左右的氨基酸和C端450个氨基酸为膜位区域(见图1),除去膜位蛋白,其余序列分3段来表达,每段200-300个左右氨基酸。并且在克隆表达后每个蛋白增加一段17个氨基酸的HIS tag(MGHHHHHHHHHHSEFAD(SEQ ID NO:16))。在随后的Western印迹结果显示IMP的第二段(IMP2,从第455个氨基酸到755个氨基酸)表达蛋白呈强阳性,表明该段蛋白能与肠上皮表面粘蛋白相识别并杂交,而且由于其它几个表达蛋白均含有相同的tag而与粘蛋白没有结合,故该段tag对黏附作用没用影响。
在体内研究细菌的黏附定植较为困难,所以目前多采用肠上皮粘液、上皮细胞及上皮下组织三种体外模型。本发明人的肠上皮细胞(Caco-2)模型显示,在先加入乳酸杆菌的情况下,乳酸杆菌的黏附率要高于后加入组,而无论是先加还是后加乳酸杆菌,同单放EPEC相比,EPEC同Caco-2细胞的黏附率均明显降低,分别降低2倍及6倍以上,其结果与乳酸菌的黏附率也相对应,这表明了植物乳酸杆菌可以同EPEC竞争黏附Caco-2细胞,乳酸杆菌的抢先占领发挥着重要作用。
同时,本发明人通过多克隆抗体对IMP2作抗体封闭的情况下,发现乳酸杆菌的黏附率较未封闭时明显降低,同时EPEC的黏附率分别较未封闭的各组增加了一倍左右,这也表明了IMP2的数量同EPEC的黏附率呈负相关,进一步说明了其在乳酸杆菌黏附过程中的重要作用。至于在抗体加入后,先入乳酸杆菌组的EPEC黏附率未能升高到单用EPEC的水平,本发明人认为乳酸杆菌表层除了黏附蛋白外,还存在着其他一些黏附分子如脂磷壁酸和胞外多糖发挥着黏附的作用,在黏附蛋白被封闭的情况下,它们的非特异性黏附发挥着作用,通过抢先占领抑制EPEC的黏附;另外可能还存在其它类型的黏附蛋白,这些蛋白并非是同粘液结合为主,在前面的实验中未能检出,抗体封闭对它们没有效果,可以继续发挥同细胞的黏附作用,但从试验数据看可以判断这些蛋白不是起主要作用的黏附蛋白;而且抗体使用的不足也可能引起IMP2未完全封闭而发挥作用;此外有研究显示,乳酸杆菌不仅通过竞争细胞表面位点,还可以分泌抗菌物质或调节PH值等方法拮抗EPEC的黏附作用。
总之,这些结果显示,IMP是一种黏附蛋白,它的黏附区域位于第二段,它不仅能通过该区域同粘蛋白相黏附,而且还与肠上皮直接黏附有关。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
 价值度评估
价值度评估
技术价值
经济价值
法律价值
0 0 054.0分
0 50 75 100专利价值度是通过科学的评估模
型对专利价值进行量化的结果,
基于专利大数据针对专利总体特
征指标利用计算机自动化技术对
待评估专利进行高效、智能化的
分析,从技术、经济和法律价值
三个层面构建专利价值评估体
系,可以有效提升专利价值评估
的质量和效率。
总评:54.0分
该专利价值中等 (仅供参考)
本专利文献中包含【6 个技术分类】,从一定程度上而言上述指标的数值越大可以反映出所述专利的技术保护及应用范围越广。 【专利权的维持时间16 年】专利权的维持时间越长,其价值对于权利人而言越高。
技术价值 29.0
该指标主要从专利申请的著录信息、法律事件等内容中挖掘其技术价值,专利类型、独立权利要求数量、无效请求次数等内容均可反映出专利的技术性价值。 技术创新是专利申请的核心,若您需要进行技术借鉴或寻找可合作的项目,推荐您重点关注该指标。
部分指标包括:
授权周期(发明)
51 个月独立权利要求数量
0 个从属权利要求数量
0 个说明书页数
21 页实施例个数
0 个发明人数量
2 个被引用次数
0 次引用文献数量
0 个优先权个数
0 个技术分类数量
6 个无效请求次数
0 个分案子案个数
0 个同族专利数
0 个专利获奖情况
无保密专利的解密
否经济价值 6.0
该指标主要指示了专利技术在商品化、产业化及市场化过程中可能带来的预期利益。 专利技术只有转化成生产力才能体现其经济价值,专利技术的许可、转让、质押次数等指标均是其经济价值的表征。 因此,若您希望找到行业内的运用广泛的热点专利技术及侵权诉讼中的涉案专利,推荐您重点关注该指标。
部分指标包括:
申请人数量
1申请人类型
机关团体许可备案
0 次权利质押
0 次权利转移
0 个海关备案
否法律价值 19.0
该指标主要从专利权的稳定性角度评议其价值。专利权是一种垄断权,但其在法律保护的期间和范围内才有效。 专利权的存续时间、当前的法律状态可反映出其法律价值。故而,若您准备找寻权属稳定且专利权人非常重视的专利技术,推荐您关注该指标。
部分指标包括:
存活期/维持时间
16法律状态
无权-未缴年费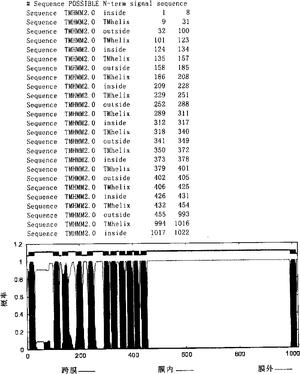









 苏公网安备 32041202001399号
苏公网安备 32041202001399号



 loading...
loading...