【中国发明,中国发明授权】融合基因TTTY15-USP9Y及其作为前列腺癌标志物的应用
有权-审定授权 中国
- 申请号:
- CN201510067493.5
- 专利权人:
- 上海长海医院
- 授权公告日/公开日:
- 2017.06.23
- 专利有效期:
- 2015.02.09-2035.02.09
- 技术分类:
- C12:生物化学,啤酒,烈性酒,果汁酒,醋
- 转化方式:
- 转让
- 价值度指数:
-
- 57.0分
- 价格:
- 面议
- 专利信息&法律状态
- 专利自评
- 专利技术文档
- 价值度指数
- 发明人阵容
 著录项
著录项
- 申请号
- CN201510067493.5
- 申请日
- 20150209
- 公开/公告号
- CN104611336A
- 公开/公告日
- 20150513
- 申请/专利权人
- [上海长海医院]
- 发明/设计人
- [孙颖浩, 任善成, 朱亚生]
- 主分类号
- C12N15/113
- IPC分类号
- C12N 9/0008(2013.01) C12N 9/16
- CPC分类号
- C12N 9/0008(2013.01) C12N 9/16(2013.01)
- 分案申请地址
- 国省代码
- 中国,CN,上海(31)
- 颁证日
- G06T1/00
- 代理人
- [董红曼]
 摘要
摘要
本发明公开了一种基于尿液中的融合基因(gene-fusion)TTTY15-USP9Y及其作为前列腺癌标志物的应用、以及在制备用于检测前列腺癌的芯片或制剂或试剂盒中的应用。
 法律状态
法律状态
| 法律状态公告日 | 20170623 |
| 法律状态 | 授权 |
| 法律状态信息 | 授权 |
| 法律状态公告日 | 20150610 |
| 法律状态 | 实质审查的生效 |
| 法律状态信息 | 实质审查的生效 IPC(主分类):C12N 15/113 申请日:20150209 |
| 法律状态公告日 | 20150513 |
| 法律状态 | 公开 |
| 法律状态信息 | 公开 |
 权利要求
权利要求
权利要求数量(11)
独立权利要求数量(8)
1.一种融合基因TTTY15-USP9Y,其特征在于,所述融合基因的序列如SEQ ID NO:1所示; 所述融合基因TTTY15-USP9Y为SEQ ID NO:1所示序列的全长或其片段。
2.如权利要求1所述的融合基因TTTY15-USP9Y,其特征在于,所述融合基因 TTTY15-USP9Y分离自人的尿液。
6.权利要求1所述的融合基因TTTY15-USP9Y在制备用于检测前列腺癌的芯片、制剂或试 剂盒中的应用。
3.一种分离的多核苷酸,其特征在于,所述多核苷酸能被转录成权利要求1所述的融合基因 TTTY15-USP9Y。
4.一种载体,其特征在于,其含有权利要求1所述融合基因TTTY15-USP9Y或权利要求3 所述的多核苷酸。
5.权利要求1所述的融合基因TTTY15-USP9Y作为前列腺癌检测的标志物的应用。
7.一种芯片、制剂或试剂盒,其特征在于,其含有如权利要求1所述的融合基因 TTTY15-USP9Y或如权利要求3所述的多核苷酸。
8.一种融合基因TTTY15-USP9Y芯片,其特征在于,所述融合基因TTTY15-USP9Y芯片包 括:
固相载体;以及有序固定在所述固相载体上的寡核苷酸探针,所述寡核苷酸探针特异性地 对应于权利要求1所述融合基因TTTY15-USP9Y所示的部分或全部序列。
9.权利要求7或8所述芯片在制备用于检测前列腺癌的试剂盒中的应用。
10.如权利要求9所述的应用,其特征在于,通过融合基因TTTY15-USP9Y芯片检测待测对 象的尿液中的融合基因TTTY15-USP9Y含量;所述检测步骤包括:先获得分离自待测对 象尿液的RNA样品,在所述RNA上设置标记物,将其与所述融合基因TTTY15-USP9Y 芯片接触,杂交形成寡核苷酸探针-RNA二元复合物,检测得到融合基因TTTY15-USP9Y 含量。
11.一种试剂盒,其特征在于,所述试剂盒中含有权利要求7或8所述的芯片。
1.一种融合基因TTTY15-USP9Y,其特征在于,所述融合基因的序列如SEQ ID NO:1所示;所述融合基因TTTY15-USP9Y为SEQ ID NO:1所示序列的全长或其片段。
2.如权利要求1所述的融合基因TTTY15-USP9Y,其特征在于,所述融合基因TTTY15-USP9Y分离自人的尿液。
3.一种分离的多核苷酸,其特征在于,所述多核苷酸能被转录成权利要求1所述的融合基因TTTY15-USP9Y。
4.一种载体,其特征在于,其含有权利要求1所述融合基因TTTY15-USP9Y或权利要求3所述的多核苷酸。
5.权利要求1所述的融合基因TTTY15-USP9Y作为前列腺癌检测的标志物的应用。
6.权利要求1所述的融合基因TTTY15-USP9Y在制备用于检测前列腺癌的芯片、制剂或试剂盒中的应用。
7.一种芯片、制剂或试剂盒,其特征在于,其含有如权利要求1所述的融合基因TTTY15-USP9Y或如权利要求3所述的多核苷酸。
8.一种融合基因TTTY15-USP9Y芯片,其特征在于,所述融合基因TTTY15-USP9Y芯片包括:
固相载体;以及有序固定在所述固相载体上的寡核苷酸探针,所述寡核苷酸探针特异性地对应于权利要求1所述融合基因TTTY15-USP9Y所示的部分或全部序列。
9.权利要求7或8所述芯片在制备用于检测前列腺癌的试剂盒中的应用。
10.如权利要求9所述的应用,其特征在于,通过融合基因TTTY15-USP9Y芯片检测待测对象的尿液中的融合基因TTTY15-USP9Y含量;所述检测步骤包括:先获得分离自待测对象尿液的RNA样品,在所述RNA上设置标记物,将其与所述融合基因TTTY15-USP9Y芯片接触,杂交形成寡核苷酸探针-RNA二元复合物,检测得到融合基因TTTY15-USP9Y含量。
11.一种试剂盒,其特征在于,所述试剂盒中含有权利要求7或8所述的芯片。
 说明书
说明书
技术领域
本发明属于分子生物学领域,具体地,本发明涉及尿液长链非编码TTTY15-USP9Y及其作为前列腺癌标志物的应用。
背景技术
前列腺癌(Prostatic Cancer,PCa)是一种严重威胁男性健康的恶性肿瘤,其发病及死亡率高峰在70岁左右,占全球肿瘤发病率第二位、死亡率第六位。我国PCa的发病率近年来一直处于显著的上升趋势。在北京、上海、广州等医学、经济发达城市,PCa发病率已位于当地十大常见肿瘤之列。来自上海市疾病控制中心的资料进一步显示,PCa的发病率自2002年起已跃居男性泌尿生殖系恶性肿瘤的首位,从1990年2.6/10万上升到2009年32.23/10万,跃居男性恶性肿瘤的第5位。流行病学数据还显示,中国PCa发病率已从1993年的1.71/10万男性人口增加到2005年的7.9/10万男性人口,年增幅13%。
PCa一旦突出包膜就失去了根治手术的机会,其患者生存时间大大下降,因此,PCa的早期诊断就显得尤为重要。血清PSA检测是目前应用最为广泛的PCa早期诊断分子标志物,它的应用大大降低了PCa特异性死亡。但是,PSA是前列腺特异性而非PCa特异性分子标记物,诸如前列腺炎、良性前列腺增生等都能引起PSA的升高。在PSA的“诊断灰区”(PSA4-10ng/ml),其诊断阳性率仅为25-40%,这就导致了众多的不必要的穿刺,同时,也给穿刺患者带来了经济负担和精神负担。所以,临床上亟需找到更具敏感性和特异性的分子标志物。
发明内容
本发明的目的为提供一种前列腺癌标志物融合基因(gene-fusion)TTTY15-USP9Y及其应用,即尿液融合基因TTTY15-USP9Y作为前列腺癌标志物的应用。
在本发明的第一方面,提供了一种从尿液中分离的融合基因TTTY15-USP9Y,所述融合基因TTTY15-USP9Y序列SEQ ID NO:1所示序列的全长或其片段。本发明所检测的特异性的融合基因片段序列如SEQ ID NO:1所示,其由两个基因TTTY15(基因ID为64595;NCBIReference Sequence:NR_001545.2;其全长序列数据库链接为:http://www.ncbi.nlm.nih.gov/nuccore/142379120)以及基因USP9Y(基因ID:8287,NCBIReference Sequence:NG_008311.1,其基因全长序列数据库链接为:http://www.ncbi.nlm.nih.gov/nuccore/195228748)在转录阶段特异性地契合而成。
本发明中,所述融合基因TTTY15-USP9Y序列为SEQ ID NO:1所示序列的全长或其片段。所述片段包括融合基因TTTY15-USP9Y的任意一个PCR片段,该任意一个PCR片段为PCR反应产物,因不同的PCR引物可获得不同的PCR产物。
SEQ ID NO:1为:
CTCATCACCTGGAGTCCGTGTAAGCTCGGCGACAGCCCTAGCAGCGAGGCCAAAACAGTTTGGGAAGAAAGAAAACCTAAAGTATTTGCCGTTGGTGATTCAAGGGAATCAAACTTGACGTATGGAGCCAAGAAAGCCCTTGGAAAAACTGGCCTCATATTTTGTGTACACAGTCCCTGTACAGGGTTTCTGACCTGTGA|gagcttggagataattctggtggctgtgtggagtatgtgttggaggtattaaattttcacagtatatataaggcagcaattgataggcctttcacagattcttctgataactacataaagagacaaaaaaaagaaaaaagagcaaagatctgtgctgtgtcaagtatgacagccatcactcatggctctccagtaggagg
(其中分隔符“|”之前的片段来自TTTY15,分割后“|”之后的片段来自USP9Y)
在另一优选例中,所述融合基因TTTY15-USP9Y分离自人的尿液。
在另一优选例中,所述尿液为前列腺按摩后尿液。所述尿液还包括非前列腺按摩后尿液。
在另一优选例中,所述融合基因TTTY15-USP9Y提取自尿液离心后的尿沉渣。
在本发明的第二方面,提供了一种分离的前体融合基因TTTY15-USP9Y,所述的前体融合基因能在人细胞内剪切并表达成第一方面所述的融合基因TTTY15-USP9Y。
在另一优选例中,所述的融合基因TTTY15-USP9Y前体分离自人前列腺按摩后尿液,还可以分离自非前列腺按摩后尿液。
在本发明的第三方面,提供了一种分离的多核苷酸,所述多核苷酸能被转录成第一方面所述的融合基因TTTY15-USP9Y。
在另一优选例中,所述多核苷酸能被人细胞转录成第一方面所述的融合基因TTTY15-USP9Y。
在另一优选例中,所述的多核苷酸具有式(I)所示的结构:
Seq正向-X-Seq反向 式(I),
式(I)中,
Seq正向为能在人细胞中表达成所述的融合基因TTTY15-USP9Y的核苷酸序列;
Seq反向为与Seq正向基本上互补或完全互补的核苷酸序列;
X为位于Seq正向和Seq反向之间的间隔序列,并且所述间隔序列与Seq正向和Seq反向均不互补;并且,式(I)所示的结构在转入人细胞后,形成式(II)所示的二级结构:
式(II)中,Seq正向、Seq反向和X的定义如上述,Seq正向为能在人细胞中表达成所述的融合基因TTTY15-USP9Y的核苷酸序列;Seq反向为与Seq正向基本上互补或完全互补的核苷酸序列;X为位于Seq正向和Seq反向之间的间隔序列,并且所述间隔序列与Seq正向和Seq反向均不互补;||表示在Seq正向和Seq反向之间形成的碱基互补配对关系。
在本发明的第四方面,提供了一种载体,其含有第一方面所述融合基因TTTY15-USP9Y或第三方面所述的多核苷酸。
在本发明的第五方面,提供了一种芯片、制剂或试剂盒,其含有第一方面所述的融合基因TTTY15-USP9Y或第三方面所述的多核苷酸,用于肿瘤的诊断。所述肿瘤包括但不限于前列腺癌、肾癌、膀胱癌等。
在本发明的第六方面,提供了一种融合基因TTTY15-USP9Y芯片,所述芯片包括:
固相载体;以及有序固定在所述固相载体上的寡核苷酸探针,所述寡核苷酸探针特异性地对应于融合基因TTTY15-USP9Y所示的部分或全部序列。
在本发明的第七方面,提供了第六方面所述的融合基因TTTY15-USP9Y芯片的用途,用于制备肿瘤诊断的试剂盒。所述肿瘤包括但不限于前列腺癌、肾癌、膀胱癌等。
本发明应用中,通过融合基因TTTY15-USP9Y芯片检测待测对象(例如人)的尿液中的融合基因TTTY15-USP9Y的含量。所述检测的步骤包括:先获得分离自待测对象尿液的RNA样品,在所述RNA上设置标记物;将其与所述融合基因TTTY15-USP9Y芯片接触,杂交形成寡核苷酸探针-RNA二元复合物;检测得到融合基因TTTY15-USP9Y含量。
本发明的另一方面,提供了所述融合基因TTTY15-USP9Y作为前列腺癌检测的标志物的应用。
在另一优选例中,所述融合基因TTTY15-USP9Y用于制备前列腺癌标志物中。
本发明的另一方面,提供了所述融合基因TTTY15-USP9Y在制备用于检测前列腺癌的芯片、制剂或试剂盒中的应用。
本发明的另一方面,提供了一种芯片、制剂或试剂盒,其含有本发明第一方面所述所述的融合基因TTTY15-USP9Y或如本发明第三方面所述的多核苷酸。所述芯片、制剂或试剂盒用于检测前列腺癌。
本发明的另一方面,提供了一种试剂盒,其含有所述融合基因TTTY15-USP9Y芯片。所述试剂盒用于检测前列腺癌。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1为本发明尿液融合基因TTTY15-USP9Y评分应用于预测PCa。
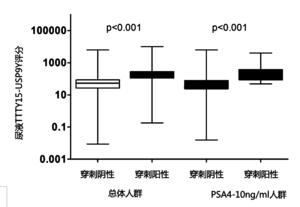
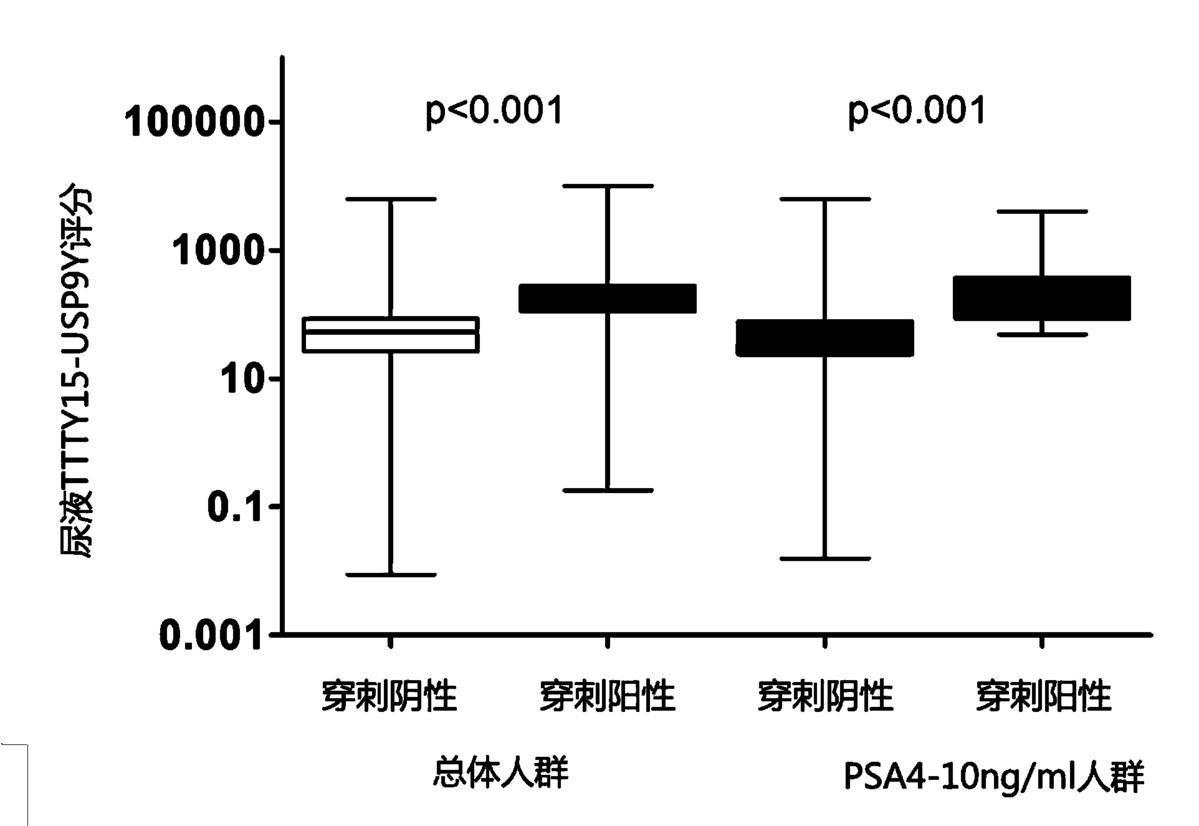
图2为尿液融合基因TTTY15-USP9Y评分在肿瘤组和穿刺阴性组病例中的表达差异。
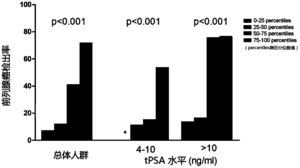
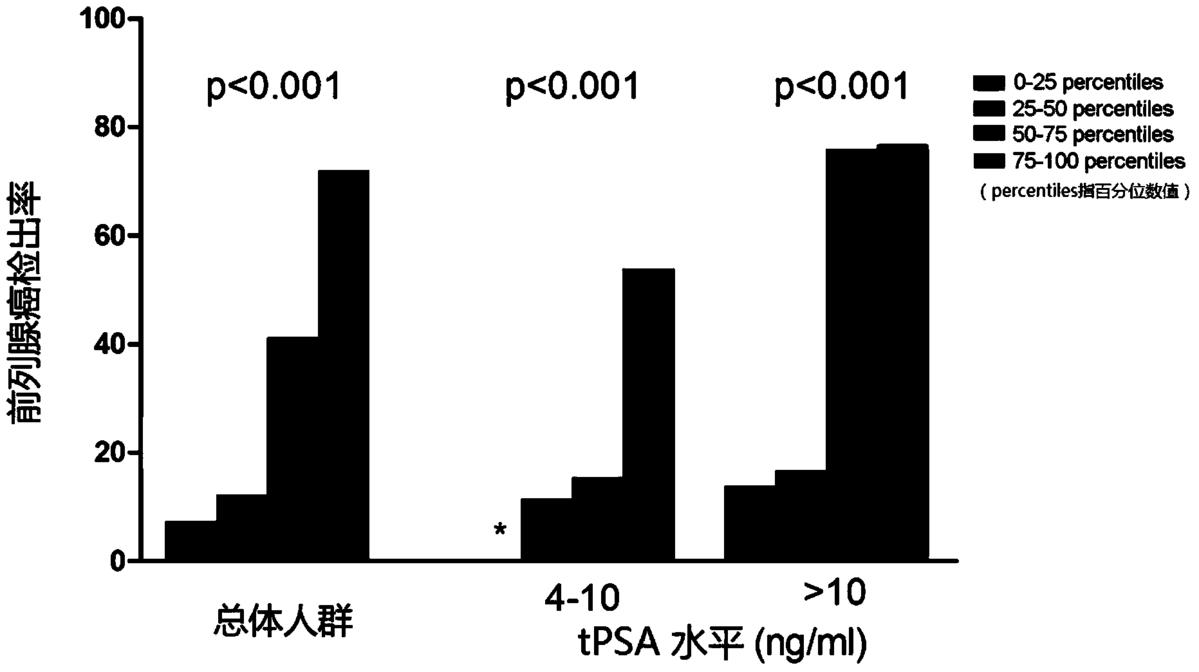
图3显示不同的尿液融合基因TTTY15-USP9Y评分在总体人群和基于PSA分组人群中的PCa区分能力。
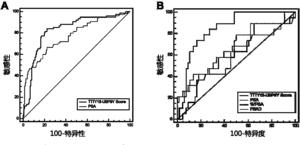
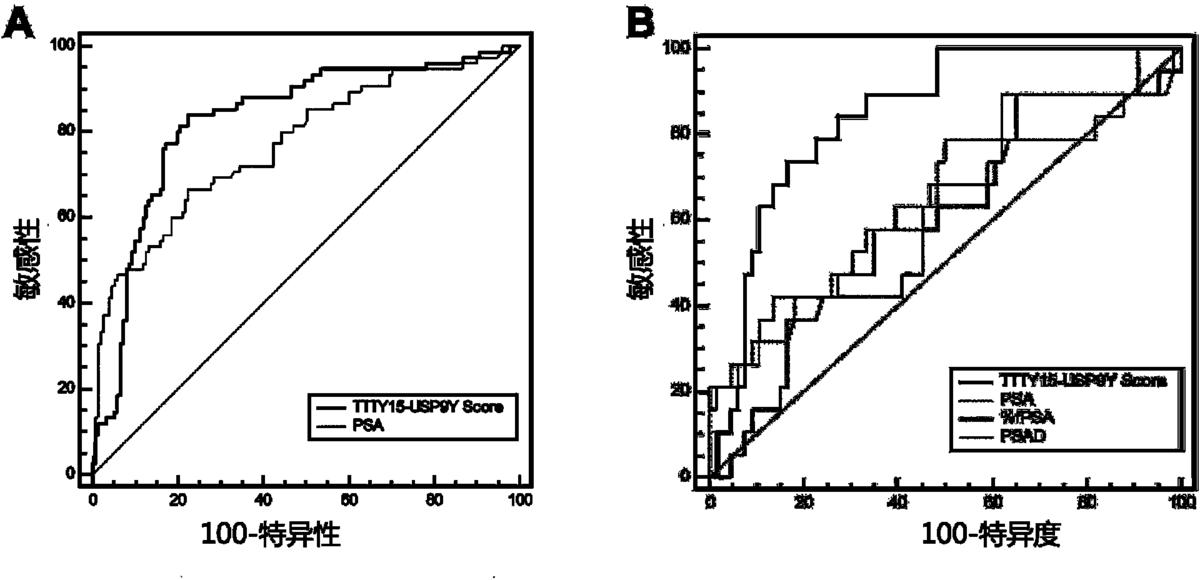
图4显示受试者工作曲线下面积分析尿液融合基因TTTY15-USP9Y评分的PCa诊断效能;(A)尿液融合基因TTTY15-USP9Y评分在发现组总体人群中的诊断效能,并且在总体人群中其诊断效能高于血清PSA;(B)尿液融合基因TTTY15-USP9Y评分在PSA“诊断灰区”人群中诊断效能,且尿液融合基因TTTY15-USP9Y评分在PSA“诊断灰区”人群中诊断效能明显优于总PSA,PSA游离比及PSAD。
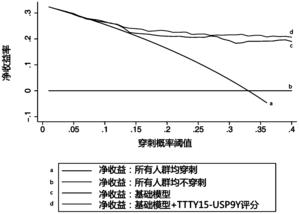
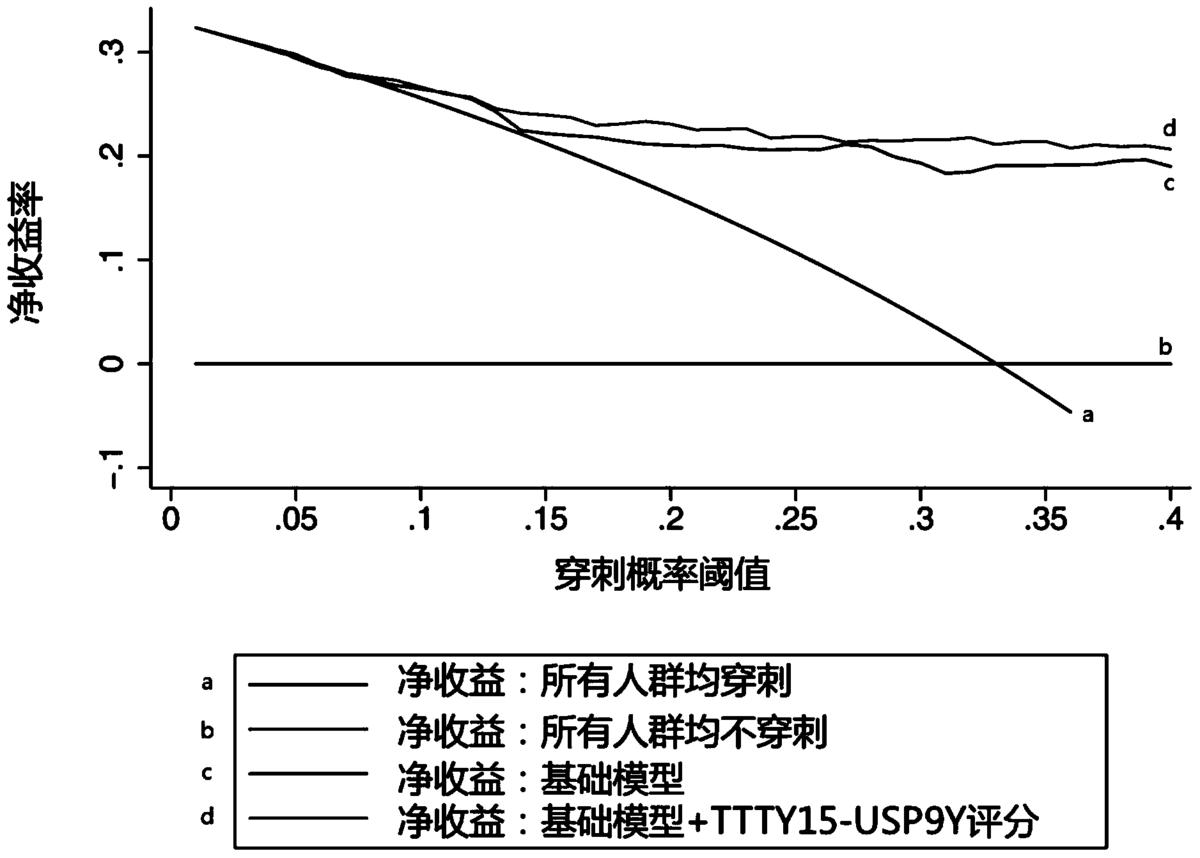
图5为决策曲线分析基于尿液融合基因TTTY15-USP9Y评分的模型在总体人群中的PCa预测作用;基础模型包括年龄、前列腺体积、血清PSA水平;平行于横轴的黑线代表所有患者均不进行前列腺穿刺;另一条与其相交的光滑实线代表所有患者都进行前列腺穿刺。
具体实施方式
本发明首次成功分离并检测了前列腺按摩后尿液中的融合基因TTTY15-USP9Y,运用多种统计学方法论证了尿液融合基因TTTY15-USP9Y评分在前列腺癌诊断中的效能。所述融合基因TTTY15-USP9Y评分可作为前列腺癌的一个独立预测因子,尿液融合基因TTTY15-USP9Y评分能明确区分前列腺穿刺阳性和阴性患者;在总体人群中,融合基因TTTY15-USP9Y评分对前列腺癌的诊断效能明显优于PSA,在PSA“诊断灰区”的患者中,尿液融合基因TTTY15-USP9Y评分的诊断效能明显优于总PSA,PSA游离比及PSAD,当临床穿刺风险定为20%时,尿液融合基因TTTY15-USP9Y评分在仅漏诊1例高级别的前列腺癌的前提下,可以避免27.1%的不必要的穿刺。因此,尿液MALAT-1评分是一种新型的前列腺癌早期诊断分子标志物,可以显著提高诊断准确性。
“尿液MALAT-1评分”是用以下计算公式得出:尿液融合基因TTTY15-USP9Y评分=TTTY1-USP9Y mRNA/PSA mRNA×1000=2Ct(PSA)-Ct(TTTY15-USP9Y)×1000。
尿液融合基因TTTY15-USP9Y
尿液中分离的融合基因TTTY15-USP9Y,所述融合基因TTTY15-USP9Y序列为融合基因TTTY15-USP9Y的全长或其片段。本发明所检测的特异性的融合基因片段序列为SEQ ID NO:1,其由两个基因TTTY15(基因ID为64595;NCBI Reference Sequence:NR_001545.2;其全长序列数据库链接为:http://www.ncbi.nlm.nih.gov/nuccore/142379120)以及基因USP9Y(基因ID:8287,NCBI Reference Sequence:NG_008311.1,其基因全长序列数据库链接为:http://www.ncbi.nlm.nih.gov/nuccore/195228748)在转录阶段特异性地契合而成。
反义寡核苷酸
如本文所用,术语“反义寡核苷酸”、“antisense-oligonucleotides”、“AS-Ons”、或“ASO”含义相同。根据本发明所提供的融合基因TTTY15-USP9Y序列,可以设计出它们的反义寡核苷酸,所述的反义寡核苷酸可在体内下调相应的融合基因的量或融合基因的表达。
在本发明中,所述的“反义寡核苷酸”还包括采用如基于核酸锁或核酸链骨架修饰技术等手段获得的经修饰的反义核苷酸,所述的修饰基本不改变反义寡核苷酸的活性,更佳地,所述修饰可提高反义寡核苷酸的稳定性、活性或治疗效果。
多核苷酸构建物
根据本发明所提供的人融合基因TTTY15-USP9Y序列,可设计出在被导入后可被加工成可影响相应的mRNA表达的融合基因的多核苷酸构建物,也即所述多核苷酸构建物能够在体内上调相应的融合基因的表达量。因此,本发明提供了一种分离的多核苷酸(构建物),所述的多核苷酸(构建物)可被人细胞转录成融合基因。
作为本发明的一种优选方式,所述的多核苷酸构建物含有式(I)所示的结构:
Seq正向-X-Seq反向 式(I),
式(I)中,
Seq正向为可在细胞中表达成所述的融合基因的核苷酸序列,Seq反向为与Seq正向基本上互补的核苷酸序列;或者,Seq反向为可在细胞中表达成所述的TTTY15-USP9Y的核苷酸序列,Seq正向为与Seq正向基本上互补的核苷酸序列;
X为位于Seq正向和Seq反向之间的间隔序列,并且所述间隔序列与Seq正向和Seq反向不互补。
式(I)所示的结构在转入细胞后,形成式(II)所示的二级结构:
式(II)中,Seq正向、Seq反向和X的定义如上述;Seq正向为可在细胞中表达成所述的融合基因的核苷酸序列,Seq反向为与Seq正向基本上互补的核苷酸序列;或者,Seq反向为可在细胞中表达成所述的TTTY15-USP9Y的核苷酸序列,Seq正向为与Seq正向基本上互补的核苷酸序列;X为位于Seq正向和Seq反向之间的间隔序列,并且所述间隔序列与Seq正向和Seq反向分别均不互补;||表示在Seq正向和Seq反向之间形成的碱基互补配对关系。
在一个具体实施方案中,所述核苷酸序列与SEQ ID NO:1的碱基互补配对。
通常,所述多核苷酸构建物位于表达载体上。因此,本发明还包括一种载体,它含有所述的融合基因或所述的多核苷酸构建物。所述的表达载体通常还含有启动子、复制起点和/或标记基因等。
本领域的技术人员熟知的方法能用于构建本发明所需的表达载体。这些方法包括体外重组DNA技术、DNA合成技术、体内重组技术等。所述的表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如卡拉霉素、庆大霉素、潮霉素、氨苄青霉素抗性。
芯片
利用本发明所述的融合基因TTTY15-USP9Y序列,还可以制备相应的融合基因检测芯片,进而研究其表达谱以及融合基因表达的调节方式。
本发明的所述的融合基因芯片包括:固相载体;以及有序固定在所述固相载体上的寡核苷酸探针,所述的寡核苷酸探针特异性地对应于融合基因所示的部分或全部序列。
具体地,可根据本发明所述的融合基因,设计出适合的探针,固定在固相载体上,形成“寡核苷酸阵列”。所述的“寡核苷酸阵列”是指具有可寻址位置(即以区别性的,可访问的地址为特征的位置)的阵列,每个可寻址位置均含有一个与其相连的特征性寡核苷酸。根据需要,可将寡核苷酸阵列分成多个亚阵。
所述固相载体可采用基因芯片领域的各种常用材料,例如但不限于尼龙膜,经活性基团(如醛基、氨基等)修饰的玻片或硅片、未修饰的玻片、塑料片等。
所述的融合基因TTTY15-USP9Y芯片的制备可采用本领域已知的生物芯片的常规制造方法。例如,如果固相载体采用的是修饰玻片或硅片,探针的5’端含有氨基修饰的聚dT串,可将寡核苷酸探针配制成溶液,然后采用点样仪将其点在修饰玻片或硅片上,排列成预定的序列或阵列,然后通过放置过夜来固定,就可得到本发明的芯片。如果核酸不含氨基修饰,则其制备方法也可参照:王申五主编的《基因诊断技术-非放射性操作手册》;J.Lerisi,V.R.Iyer,P.O.BROWN。Exploring the metabolic and genetic control of gene expression on a genomic scale。Science,1997;278:680和马立人,蒋中华主编。生物芯片。北京:化学工业出版社,2000,1-130。
另一方面,本发明还提供了一种通过融合基因TTTY15-USP9Y芯片检测人尿液中融合基因TTTY15-USP9Y的方法,包括步骤:
(1)提供分离自人尿液的RNA样品,在所述的RNA上设置标记物;
(2)将(1)的RNA与所述的芯片接触,使所述的RNA与固相载体上的寡核苷酸探针发生杂交反应,从而在固相载体上形成“寡核苷酸探针-RNA”二元复合物;
(3)检测(2)形成的二元复合物的标记物,从而确定人组织中相应的融合基因TTTY15-USP9Y的含量。
从人组织中提取RNA的方法是本领域技术人员熟知的方法,包括Trizol法。
更优选的,在步骤(1)中,在从人尿液中分离出RNA样品后,对RNA样品进行适当处理,以富集具有一定长度的RNA,所述长度一般在150-250nt之间。在经过上述处理后,利用这些小片段RNA进行后续的杂交,这样可提高芯片捕获融合基因TTTY15-USP9Y的准确性。
本领域人员可方便地分离出具有一定片段长度的RNA,比如可采用凝胶电泳法来分离。对RNA进行标记也是本领域技术人员熟知的方法,其可通过在杂交时加入与RNA特异性结合的标记物的方法实现,所述标记物比如是标记基团。所述的标记基团包括但不限于:地高辛分子(DIG)、生物素分子(Bio)、荧光素及其衍生生物分子(FITC等)、其它荧光分子(如Cy3、Cy5等)、碱性磷酸酶(AP)、辣根过氧化物酶(HRP)等。这些标记及其标记方法都已是本领域众所周知的常规技术。
将上述的RNA与融合基因TTTY15-USP9Y芯片进行杂交时,可以先将融合基因TTTY15-USP9Y芯片与预杂交缓冲液进行预杂交。
本发明所述的RNA与融合基因TTTY15-USP9Y芯片之间的固相杂交按照本领域的经典方法进行,本领域一般人员依据经验容易确定有关缓冲液、探针和样本浓度、预杂交温度、杂交温度以及时间等的最适条件。或者也可以参照《分子克隆实验指南》中所述的。
然后根据标记信号在lncRNA芯片上的位置、强度等信息获取待测信息。若扩增产物用荧光基团标记,也可直接用荧光检测设备(如激光共聚焦扫描仪Scanarray 3000等)获取待测信息。
检测试剂盒
本发明还提供了一种试剂盒,所述试剂盒中含有本发明的芯片。所述试剂盒可用于检测尿液中所述融合基因TTTY15-USP9Y的表达。本发明还提供一种含有所述融合基因TTTY15-USP9Y或所述多核苷酸的制剂或试剂盒,用于检测尿液中所述融合基因TTTY15-USP9Y的表达。
优选的,所述的制剂或试剂盒中还含有用于标记RNA样品的标记物,以及与所述标记物相对应的底物。
此外,所述的制剂或试剂盒中还可包括用于提取RNA、PCR、杂交、显色等所需的各种试剂,包括但不限于:抽提液、扩增液、杂交液、酶、对照液、显色液、洗液、抗体等。
此外,所述的试剂盒中还可包括使用说明书和/或芯片图像分析软件。
下面结合具体实施例和附图,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。实施本发明的过程、条件、试剂、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。下列实施例中未注明具体条件的实验方法,通常按照常规条件如Sambrook等人,分子克隆:实验室手册(New York:Cold Spring Harbor LaboratoryPress,1989)中所述的条件,或按照制造厂商所建议的条件。
实验方法
实验样本
本实验所有临床标本均来自于上海长海医院。所有标本的使用均由病人或其委托人签署知情同意书。所有涉及人体标本的研究均事先获得各医院伦理委员会的批准。尿液标本来自于因PSA异常升高(PSA>4ng/ml)或直肠指诊阳性而进行穿刺的患者。尿液标本均为行前列腺按摩后标本。所有患者在留取标本前均未进行过影响血清PSA的治疗。
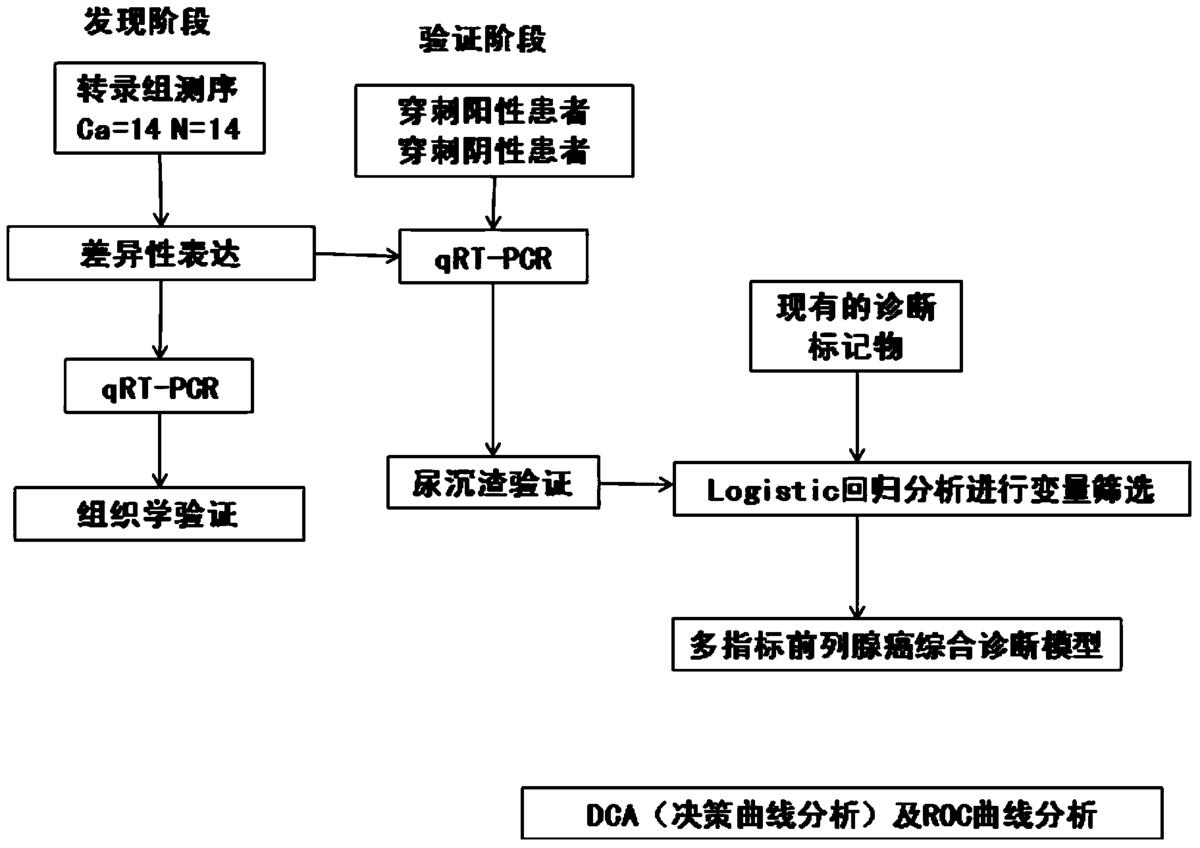
研究设计
研究分为两个阶段进行,实验设计方案见图1:(1)发现阶段。我们通过对14对样本的转录组测序发现在肿瘤及癌旁正常组织中差异性表达的融合基因。(2)验证阶段。我们回顾性选取226例连续性前列腺穿刺病人(75例穿刺阳性患者及151例穿刺阴性患者)的尿沉渣,以检验检测尿液沉渣中融合基因TTTY15-USP9Y评分预测前列腺穿刺结果的诊断效能,特别是在PSA“诊断灰区”中的预测价值,并联合现有的诊断标记物及临床指标,构建新型的多指标综合诊断模型,并进行临床决策分析。
标本的收集和处理
在穿刺前,按摩前列腺后(按照按摩前列腺液的方法,从前列腺底至尖部,分别从两侧叶的外侧至中线按压前列腺,最后按压前列腺中央沟。按压力度以将前列腺表面按压0.5-1.0cm为度。按压两侧叶从上至下各3次,重复一次,按压中央沟3次。)收集第一次尿液30-40ml,立即至于4度冰箱。2500g,15min,4℃离心,分离出尿沉渣,将沉渣转移至1ml去酶EP管中(一般使用1ml去RNA酶PBS冲洗沉渣,后转移至EP管中再使用上述方法离心)。-80℃长期保存。
实时定量PCR
使用TRIzol法(Invitrogen:No 15596-026,USA)提取尿沉渣中总RNA,将抽提好的总RNA使用NANO Drop 2000测定浓度及260/280nm吸光度,260/280nm吸光度比值在1.8~2.0之间说明RNA质量良好,根据测得的RNA浓度,每个样本定量50ng的RNA用于全基因组扩增(WTA2,Sigma-Aldrich,St.Louis,MO,USA)。
采用美国ABI公司的实时定量PCR仪(ABI StepOne Plus)对尿液中TTTY15-USP9Y的cDNA进行检测,SYBR Green染料掺入法检测(Takara:DRR081A TaKaRa,Japan),反转录获得的cDNA稀释10倍,以20ul为反应体系,使用ABI八连PCR管。每孔设置3个复孔。扩增条件为:95℃预变性60sec,之后95℃变性15sec,60℃延伸60sec,共40个循环,得到目标基因及内参的Ct值。PSAKIT上游引物:GTCTGCGGCGGTGTTCTG,PSAKIT下游引物:TGCCGACCCAGCAAGATC;TTTY15-USP9Y上游引物:CATCACCTGGAGTCCGTGTAAG,TTTY15-USP9Y下游引物:CCTACTGGAGAGCCATGAGTG。反应体系为:2μl cDNA,Premix Ex TaqTM(Perfect Real Time)(2×)(Takara:DRR081A TaKaRa,Japan),0.4μlROX Reference Dye(50×)和5.6μl水。所有反应数据均由StepOne Software version v2.1(Applied BioSystems,USA)分析得出。样本PSA表达量超过28Ct值将被剔除,原因是这例样本没有收集到足够的前列腺细胞。尿液TTTY15-USP9Y评分计算公式为:2Ct(PSA)-Ct(TTTY15-USP9Y)×1000。
统计学分析
用SPSS Statistics version 18.0(SPSS,Chicago,IL,USA),MedCalc statistical software version10.4.7.0(MedCalc Software bvba,Mariakerke,Belgium)以及Stata12(Statacorp,College Station,TX)对数据进行统计学分析,选取适当的Mann-Whitney U-test,Student’s t-test,Pearson’schi-square test and Fisher’s exact test对各组连续性和记数变量进行统计学检测;运用单因素和多因素logistic回归来预测PCa的独立危险因素;运用Spearman rank分析尿液融合基因TTTY15-USP9Y评分与其它临床变量之间的关系;运用受试者工作曲线(ROC)确定最佳截断值(cut-off值)、特异度、敏感度、曲线下面积(AUC);运用临床决策曲线来估算尿液融合基因TTTY15-USP9Y评分的临床价值;以P<0.05为差异有统计学意义。
实施例1
临床标本信息总结
本研究入选临床连续性病例253例,其中12例因尿沉渣中RNA数量或者质量不佳而被剔除,15例因尿沉渣中没有收集到足够的前列腺细胞而被剔除,因此,本研究最终病例数为226例。所有病例临床信息总结于表1中。从表1中可以看出,所有穿刺病人血清PSA平均值为10.2ng/ml(四分位间距:7.1-17.7ng/ml),穿刺Gleason评分7分的占到38.6%。在总体人群中,PCa相关危险因素(年龄、总PSA、前列腺体积、PSA游离比和直肠指诊)以及尿液融合基因TTTY15-USP9Y评分在穿刺阳性组中都显著高于穿刺阴性组,同时在PSA“诊断灰区”人群中,尿液融合基因TTTY15-USP9Y评分在穿刺阳性组中也显著高于穿刺阴性组,这表明尿液融合基因TTTY15-USP9Y评分在PSA“诊断灰区”中也具有较好的诊断作用。
实施例2
尿液融合基因TTTY15-USP9Y评分可以明确区分肿瘤组和穿刺阴性组并与PCa的检出率高度相关
为了研究尿液融合基因TTTY15-USP9Y评分是否能作为一种有效的PCa分子标志物,本研究发明人在所有穿刺入组人群中检测了尿液融合基因TTTY15-USP9Y评分,并作了进一步的统计学分析。研究发现,不管是在总体人群中还是在PSA“诊断灰区”人群中,尿液融合基因TTTY15-USP9Y评分在穿刺阳性组中的表达量都明显高于穿刺阴性病例,如图2所示的尿液融合基因TTTY15-USP9Y评分在穿刺阳性组(肿瘤组)和穿刺阴性组病例中的表达差异,尿液融合基因TTTY15-USP9Y评分在总体人群以及PSA“诊断灰区”(4-10ng/ml)人群中,在穿刺阳性组均明显高于穿刺阴性组病例。
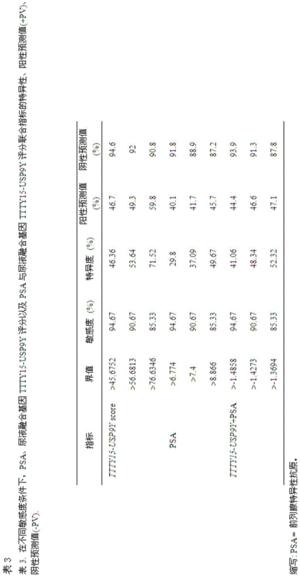
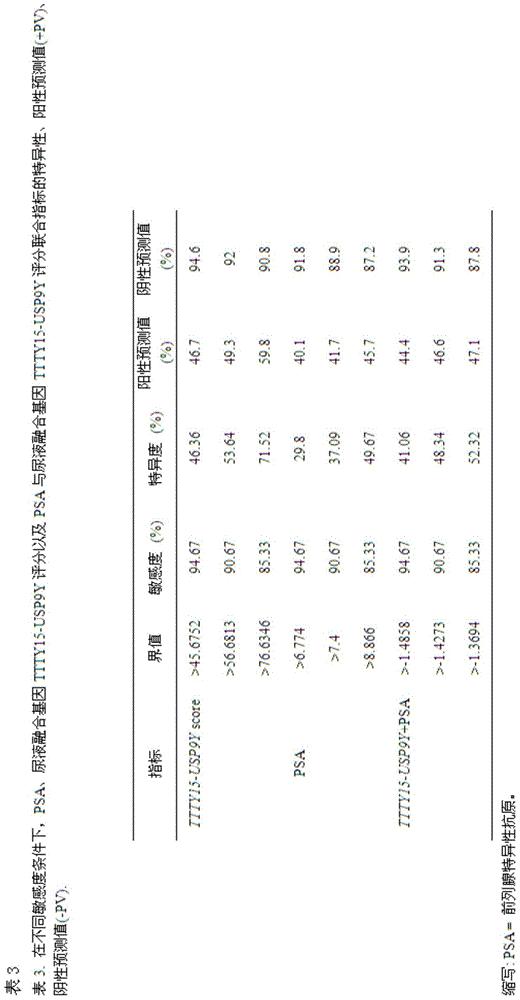
更为重要的是,本发明人评价了尿液融合基因TTTY15-USP9Y评分在总体人群和基于PSA分组人群中的PCa区分能力。发现在总体人群和PSA“诊断灰区”人群中,随着尿液融合基因TTTY15-USP9Y评分升高PCa的检出率明显提高,如图3所示,不同的尿液融合基因TTTY15-USP9Y评分在总体人群和基于PSA分组人群中的PCa区分能力,这说明了尿液融合基因TTTY15-USP9Y评分可以作为PCa诊断的分子标志物。表3显示了在不同敏感度条件下,PSA、尿液融合基因TTTY15-USP9Y评分以及PSA与尿液融合基因TTTY15-USP9Y评分联合指标的特异性、阳性预测值(+PV)、阴性预测值(-PV)。如表3所示,在同一敏感度下,尿液融合基因TTTY15-USP9Y评分诊断PCa的特异性都由于传统的PCa诊断标志物PSA,显示出了较好的诊断效能。
实施例3
Logistic回归分析尿液MALAT-1评分的PCa诊断效能
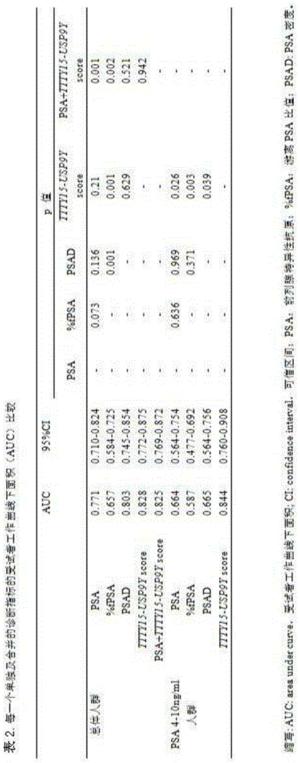
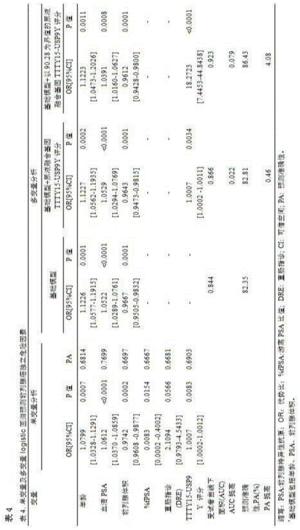
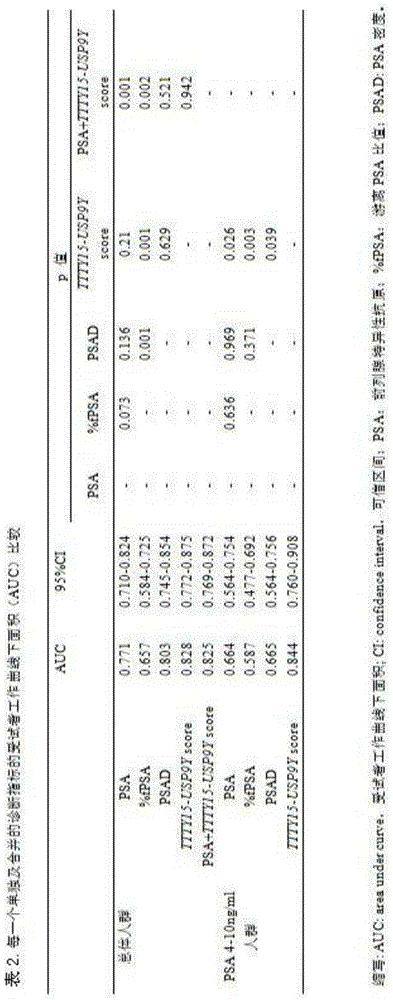
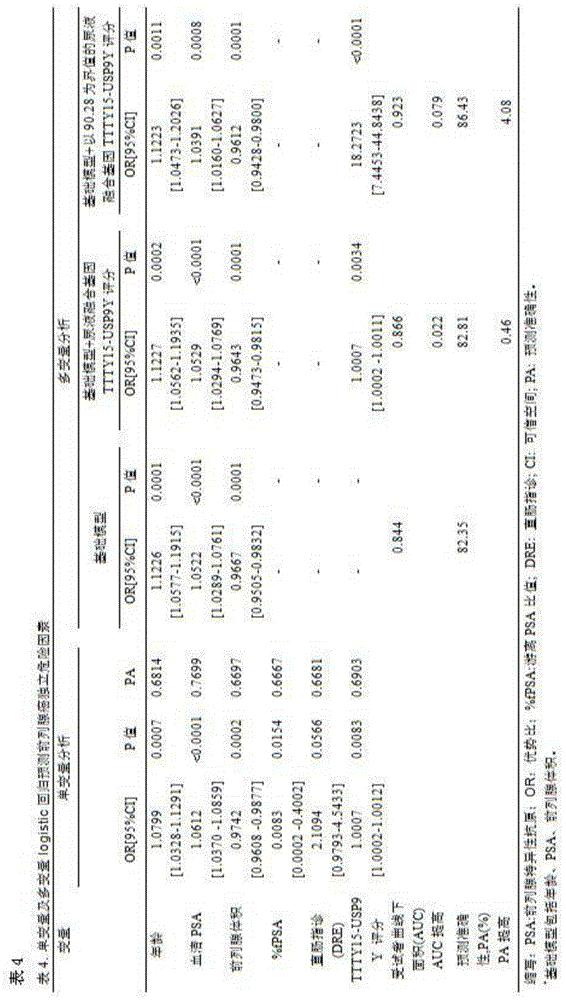
本发明人建立单因素和多因素logistic回归模型,证明了尿液融合基因TTTY15-USP9Y评分以及其它危险因素(年龄、血清PSA水平、前列腺体积)都是总体人群PCa的独立预测因子。在PSA“诊断灰区”中尿液融合基因TTTY15-USP9Y评分仍然是PCa的独立预测因子,见表2和图4所示的受试者工作曲线下面积分析尿液融合基因TTTY15-USP9Y评分以及其它危险因素诊断PCa的诊断效能。
在单因素logistic回归模型中,尿液融合基因TTTY15-USP9Y评分在总体人群中的PCa诊断效能与总PSA相比没有明显统计学差异,但是尿液合基因TTTY15-USP9Y评分与PSA合用,其诊断效能明显优于总PSA,但并不一定优于尿液合基因TTTY15-USP9Y评分。
尿液合基因TTTY15-USP9Y评分在PSA“诊断灰区”人群中的诊断效能明显优于总PSA,PSAD,见表2,图4B,同时,不管在总体人群中还是在PSA“诊断灰区”中,尿液融合基因TTTY15-USP9Y评分的诊断效能都优于PSA游离比。所有模型的预测准确性和受试者工作曲线下面积都总结于表4中。可以看出,在总体人群中,基于尿液融合基因TTTY15-USP9Y评分模型的预测准确性为82.81%和受试者工作曲线下面积为0.866,预测准确性比基础模型提高了0.46%,受试者工作曲线下面积提高了0.02;以尿液融合基因TTTY15-USP9Y截断值90.28作为界值构建诊断模型,在总体人群中,基于尿液融合基因TTTY15-USP9Y评分模型的预测准确性为86.43%和受试者工作曲线下面积为0.923,预测准确性比基础模型提高了4.08%,受试者工作曲线下面积提高了0.079。
实施例4
临床决策曲线分析尿液融合基因TTTY15-USP9Y评分预测PCa的准确性
由于本发明人发现了尿液融合基因TTTY15-USP9Y评分在整体人群中的诊断优势,故本发明人运用临床决策曲线(Decision curve analysis)详细分析了尿液融合基因TTTY15-USP9Y评分在这一人群中的临床价值。如需要了解尿液融合基因TTTY15-USP9Y评分在总体人群中的临床预测价值请参考图5,表5,表6。
如图5所示的决策曲线分析基于尿液融合基因TTTY15-USP9Y评分的模型在总体人群中的PCa预测作用。基础模型组包括年龄、前列腺体积和血清总PSA。新模型包括年龄、前列腺体积和血清总PSA以及尿液融合基因TTTY15-USP9Y评分。
在总体人群中,基于尿液融合基因TTTY15-USP9Y评分模型的临床预测能力优于基础模型(图5,表5,表6)。当临床穿刺风险定为20%时,基于尿液MALAT-1评分模型在仅漏诊1例高级别的前列腺癌的前提下,可以避免27.1%的不必要的穿刺。如图5所示的决策曲线分析基于尿液融合基因TTTY15-USP9Y评分的模型在总体人群中的PCa预测作用,平行于横轴的褐色实线代表没有1例患者进行前列腺穿刺。另一条与其相交的光滑实线代表所有患者都进行前列腺穿刺。
 价值度评估
价值度评估
技术价值
经济价值
法律价值
0 0 057.0分
0 50 75 100专利价值度是通过科学的评估模
型对专利价值进行量化的结果,
基于专利大数据针对专利总体特
征指标利用计算机自动化技术对
待评估专利进行高效、智能化的
分析,从技术、经济和法律价值
三个层面构建专利价值评估体
系,可以有效提升专利价值评估
的质量和效率。
总评:57.0分
该专利价值中等 (仅供参考)
本专利文献中包含【4 个实施例】、【3 个技术分类】,从一定程度上而言上述指标的数值越大可以反映出所述专利的技术保护及应用范围越广。 【专利权的维持时间10 年】专利权的维持时间越长,其价值对于权利人而言越高。
技术价值 32.0
该指标主要从专利申请的著录信息、法律事件等内容中挖掘其技术价值,专利类型、独立权利要求数量、无效请求次数等内容均可反映出专利的技术性价值。 技术创新是专利申请的核心,若您需要进行技术借鉴或寻找可合作的项目,推荐您重点关注该指标。
部分指标包括:
授权周期(发明)
28 个月独立权利要求数量
7 个从属权利要求数量
7 个说明书页数
17 页实施例个数
4 个发明人数量
3 个被引用次数
0 次引用文献数量
0 个优先权个数
0 个技术分类数量
3 个无效请求次数
0 个分案子案个数
0 个同族专利数
0 个专利获奖情况
无保密专利的解密
否经济价值 6.0
该指标主要指示了专利技术在商品化、产业化及市场化过程中可能带来的预期利益。 专利技术只有转化成生产力才能体现其经济价值,专利技术的许可、转让、质押次数等指标均是其经济价值的表征。 因此,若您希望找到行业内的运用广泛的热点专利技术及侵权诉讼中的涉案专利,推荐您重点关注该指标。
部分指标包括:
申请人数量
1申请人类型
机关团体许可备案
0 次权利质押
0 次权利转移
0 个海关备案
否法律价值 19.0
该指标主要从专利权的稳定性角度评议其价值。专利权是一种垄断权,但其在法律保护的期间和范围内才有效。 专利权的存续时间、当前的法律状态可反映出其法律价值。故而,若您准备找寻权属稳定且专利权人非常重视的专利技术,推荐您关注该指标。
部分指标包括:
存活期/维持时间
10法律状态
有权-审定授权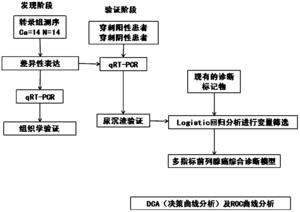










 苏公网安备 32041202001399号
苏公网安备 32041202001399号



 loading...
loading...